
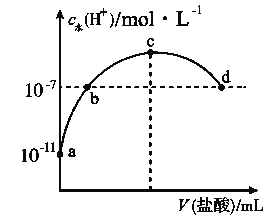
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
A. 常温下,0.1 mol·L-1氨水中![]() 的电离常数
的电离常数![]() 约为
约为![]()
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
【答案】B
【解析】
A.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=1014/1011mol/L=0.001mol/L,结合Kb=c(NH4+)c(OH)/c(NH3H2O)计算;
B.a、b之间的任意一点,溶液都呈碱性,结合电荷守恒判断离子浓度大小;
C.根据图知,c点水电离出的氢离子浓度最大,恰好反应生成氯化铵;
D. b点溶液中c点水电离出的c(H+)=10-7mol/L,常温下c(H+)·c(OH-)=Kw=10-14,据此判断。
A.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=1014/1011mol/L=0.001mol/L,Kb=c(NH4+)c(OH)/c(NH3H2O)=103×103/0.1mol/L=1×10-5mol/L,故A正确;
B.a、b之间的任意一点,溶液都呈碱性,则c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH4+),而c(Cl-)和c(OH-)的相对大小与所加盐酸的量有关,故B错误;
C.根据图知,c点水电离出的氢离子浓度最大,恰好反应生成氯化铵,铵根水解溶液呈酸性,结合电荷守恒得:c(NH4+)<c(Cl-),故C正确;
D.b点溶液中c(H+)=10-7mol/L,常温下c(H+)·c(OH-)=Kw=10-14,所以c(H+)=c(OH-),溶液呈中性,故D正确。
故选B。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】氟西汀G是一种治疗抑郁性精神障碍的药物,其一种合成路线如图:

已知:LiAIH4是强还原剂,不仅能还原醛、酮,还能还原酯,但成本较高。
回答下列问题:
(1)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。写出D的结构简式,用星号(*)标出D中的手性碳___。
(2)④的反应类型是___。
(3)C的结构简式为___。
(4)G的分子式为___。
(5)反应⑤的化学方程式为___。
(6)已知M与D互为同分异构体,在一定条件下能与氯化铁溶液发生显色反应。M分子的苯环上有3个取代基,其中两个相同。符合条件的M有__种。
(7) 也是一种生产氟西汀的中间体,设计以
也是一种生产氟西汀的中间体,设计以![]() 和
和![]() 为主要原料制备它的合成路线___(无机试剂任选)。
为主要原料制备它的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)],已知该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列说法正确的是( )
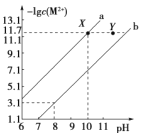
A.a线表示Fe(OH)2饱和溶液中的变化关系
B.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
C.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
D.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中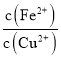 =104.6
=104.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:![]()
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3:4,与A相关的反应如下:

请回答下列问题:
(1)A的分子式为__,B的名称是__;
(2)写出C→D反应的化学方程式:__;
(3)链烃M的相对分子质量比B多24,分子中所有碳原子均在同一平面上,其结构简式是__;
Ⅱ.由E转化为对甲基苯乙炔(![]() )的一条路线如下:
)的一条路线如下:

(4)①反应中所加试剂是__; ③的反应类型是__;
(5)写出G的结构简式:__;
(6)写出两种同时符合下列条件的E的同分异构体的结构简式:__。
①属于芳香醛;
②苯环上有两种不同环境的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
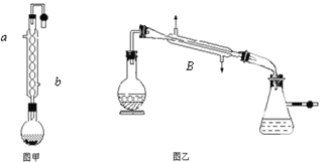
请回答下列问题
(1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______;
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______;
(3)反应中加入过量的乙醇,目的是_______;
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
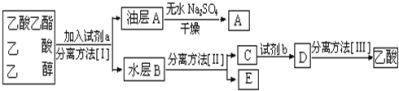
则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。合成氨反应中有关化学键键能数据如下表:
化学键 | H—H | N≡N | N—H |
E/kJmol-1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea=508kJmol-1,则氨分解反应:NH3(g)
2NH3(g)的活化能Ea=508kJmol-1,则氨分解反应:NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Ea=_____。
H2(g)的活化能Ea=_____。
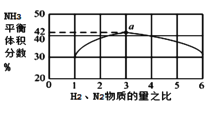
②图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据如图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。
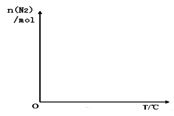
③依据温度对合成氨反应的影响,在如图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_____。
(2)选择性催化还原脱硝技术(SCR)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
①SCR脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=-1625.5kJmol-1;氨氮比
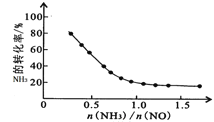
4N2(g)+6H2O(g) △H=-1625.5kJmol-1;氨氮比![]() 会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当
会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当![]() >1.0时,烟气中NO浓度反而增大,主要原因是_____。
>1.0时,烟气中NO浓度反而增大,主要原因是_____。
②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组从乙烯出发按下列路线合成两种香料X和Y。具体合成路线如图所示(部分反应条件略去):
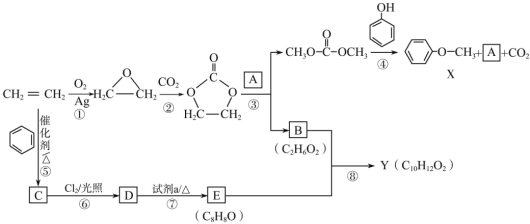
已知以下信息:
①![]()
![]() 2ROH+
2ROH+![]() ;
;
②![]()
![]()
![]() +H2O;
+H2O;
③E能发生银镜反应,1H-NMR谱图共有5个峰。
请回答:
(1)下列说法不正确的是______。
A.化合物C既能发生氧化反应,又能发生还原反应
B.1molE最多可以与3molH2发生加成反应
C.B可以和乙二酸发生缩聚反应
D.反应②为取代反应
(2)D![]() E的化学方程式是_____。
E的化学方程式是_____。
(3)化合物A的结构简式是______。
(4)写出同时符合下列条件的Y的所有同分异构体的结构简式:_____。
①能发生银镜反应,且与FeCl3溶液不会发生显色反应
②分子含苯环,1H-NMR谱图显示分子中有四种不同化学环境的氢原子
(5)参照 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备 的合成路线______(用流程图表示,无机试剂任选)。
的合成路线______(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L的烧瓶中充入一定量N2O4气体。
(1)体系中气体颜色由浅变深,写出对应的化学方程式____________________。
(2)保持温度和容积不变,向达到平衡的容器中再充入一定量N2O4气体,平衡________移动(填“正向”、“逆向”或“不”),N2O4的转化率___________(填“增大”、“减小”或“不变”,下同),反应的平衡常数___________。
(3)某小组为研究温度对化学平衡移动的影响,设计如图实验。图方案还需补充的是_____________(用文字表达);实验现象为______________________。

(4)在一定条件下,N2O4和NO2的消耗速率与压强关系为:v(N2O4)=k1·c(N2O4),v(NO2)=k2·c(NO2),设达到平衡时c(N2O4)=1 mol/L,则(1)中反应的平衡常数为_________(用k1、k2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1mol·L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的c(H+)随加入硫酸的体积变化如图所示。下列说法不正确的是

A.若a点对应水电离的c(H+)=1.0×10-11mol·L-1,则此时氨水的电离程度为1%
B.c点时氨水与硫酸恰好完全反应
C.c点对应溶液中:c(H+)-c(OH-)=c(NH3·H2O)
D.若b、d点对应水电离的c(H+)=1.0×10-7mol·L-1,则两溶液中均存在:c(NH4+)=2c(SO42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com