
【题目】下列说法正确的是( )
A.过量的100gNa2O2与CO2反应后,固体质量变成了105.6g,此反应转移电子为0.4mol
B.在Fe与含nmolHNO3的稀溶液反应中,被还原的HNO3不一定为![]() nmol
nmol
C.在Mg与Al做电极,其它溶液做电解质构成原电池中,Mg一定为负极
D.碱性氧化物一定为金属氧化物,酸性氧化物不一定是非金属氧化物
科目:高中化学 来源: 题型:
【题目】已知有关反应的能量变化如图,试回答下列问题。
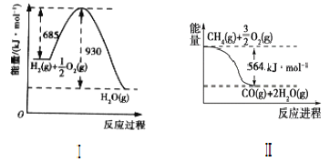
(1)根据图像,写出Ⅰ的热化学方程式:____。
(2)写出CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:____。
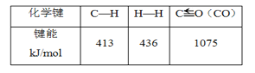
(3)在(2)的反应中,相关的化学键键能数据如下表所示。判断H2O(g)中O—H的键能为___。
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①C(s)+CO2(g)=2CO(g)△H1,C(s)+![]() O2(g)=CO(g)△H2则△H1___△H2。
O2(g)=CO(g)△H2则△H1___△H2。
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H3,CH4(g)+H2O(l)=CO(g)+3H2(g)△H4,则△H3___△H4
③2H2(g)+O2(g)=2H2O(1)△H4,2H2(g)+O2(g)=2H2O(g)△H5,则△H4___△H5。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3CH2OH和 ![]() 互为同分异构体,将两种物质分别放在下列检测仪上进行检测,显示出的信号完全相同的是
互为同分异构体,将两种物质分别放在下列检测仪上进行检测,显示出的信号完全相同的是
A.李比希元素分析仪B.红外光谱仪C.核磁共振仪D.质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗称草酸![]() 结构简式为
结构简式为![]() ,可简写为
,可简写为![]() ,它是一种重要的化工原料.
,它是一种重要的化工原料.![]() 常温下
常温下![]() 的
的![]() 、
、![]() 、
、![]() 溶液的pH如表所示.
溶液的pH如表所示.![]()
|
|
| |
pH |
|
|
|
填空:
![]() 写出
写出![]() 的电离方程式______.
的电离方程式______.
![]() 溶液显酸性的原因是______;向
溶液显酸性的原因是______;向![]() 的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.![]()
![]()
![]()
![]()
![]() 与酸性高锰酸钾溶液反应,现象是有气泡
与酸性高锰酸钾溶液反应,现象是有气泡![]() 产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
产生,紫色消失。写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是______.
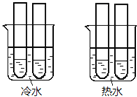
![]() 某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL
某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL![]()
![]()
![]() 溶液和4mL
溶液和4mL![]() 酸性
酸性![]() 溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究______,但该实验始终没有看到溶液褪色,推测原因______.
![]() 已知草酸
已知草酸![]() 受热分解的化学方程式为:
受热分解的化学方程式为:![]() ,写出
,写出![]() 在密闭容器中高温分解的化学方程式______.
在密闭容器中高温分解的化学方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污和生态环境保护与调水作为一个完整的系统来分析的原则。在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患。经检测,某工厂废液中含有大量的![]() 、
、![]() 、
、![]() 、
、![]() 。试分析并回答下列问题:
。试分析并回答下列问题:
(1)该废液中可能大量存在的阴离子是________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)为了回收废液中的金属银,某同学设计了如图所示的实验方案。若按照该方案获得金属银108g,在保证不污染环境且![]() 循环利用的情况下,可得出理论上应提供标准状况下的
循环利用的情况下,可得出理论上应提供标准状况下的![]() ________L。
________L。
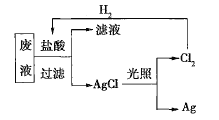
(3)为了实现(2)中氯气的循环利用,有人设想以氢气和氯气为原料利用原电池原理直接制盐酸,假设这种想法可行,下列说法肯定错误的是________(填序号)。
A 两极材料都用石墨,用稀盐酸作电解质溶液
B 通入氢气的电极为原电池的正极
C 电解质溶液中的阳离子向通入氯气的电极移动
D 通入氯气的电极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案:

下列分析正确的是
A.若m1>m2时,则混合物M中一定含有Al2O3
B.生成蓝色溶液的离子方程式为:Cu+Fe3+=Cu2++Fe2+
C.固体B既可能使纯净物,又可能是混合物
D.要确定混合物M中是否含有Al,可取M加入适量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如图,发生器内电解生成ClO2。下列说法正确的是( )
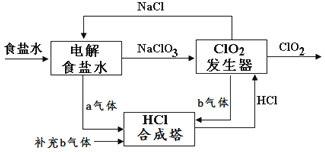
A.a气体是氯气,b气体是氢气
B.为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体
C.ClO2发生器中的还原反应为:2ClO3-+12H++10e-=Cl2↑+6H2O
D.氯化钠电解槽内每生成2mola气体,转移2mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。按要求回答:
(1)碳原子核外有________种不同空间运动状态的电子,第一电离能介于B和C之间的元素的名称为_________。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是_______________。
②MgCO3分解温度比CaCO3低的原因是_________________________。
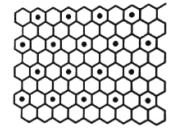
③石墨与钾可形成石墨夹层离子晶体C8K(如图),其结构为每隔一层碳原子插入一层钾原子,与钾原子层相邻的上下两层碳原子排列方式相同,则与钾最近等距的配位碳原子有_________个。
(3)碳也可形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
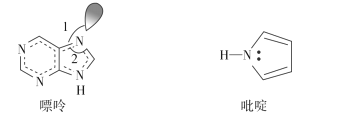
①1 mol 吡啶分子中含有σ键数目是__________。
②嘌呤结构中N原子的杂化方式为________。
③嘌呤中轨道之间的夹角∠1比∠2大,解释原因________________________________。
(4)将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构——T-碳。已知T-碳密度为ρ g/cm,阿伏加德罗常数为NA,则T-碳的晶胞参数a=________ pm (写出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25C时,0.1mol/L的3种溶液①盐酸②氨水③CH3COONa溶液。下列说法中,不正确的是
A. 3种溶液中pH最小的是①
B. 3种溶液中水的电离程度最大的是③
C. ①与②等体积混合后溶液显酸性
D. ①与③等体积混合后c(Na+)>c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com