
【题目】用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。下列说法正确的是

A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2↑
B. 电解时H+由电极I向电极II迁移
C. 吸收塔中的反应为2NO+2S2O42-+2H2O=N2+4HSO3-
D. 每处理1molNO,可同时得到32gO2
科目:高中化学 来源: 题型:
【题目】油井发生火灾,产生的大量废气中含有以下成分(①浓烟中的炭粒、②氮的氧化物、③碳的氧化物、④硫的氧化物、⑤碳氢化合物的蒸气),其中对大气造成污染并导致雨水酸化的有害、有毒气体是( )
A. ①③⑤ B. ②④ C. ②③④ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组所做实验的示意图如图所示:图中“→”表示气体流向, M是一种纯净而干燥的气体,Y为另一种气体,E内有红棕色气体产生,实验所用物质只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。据此实验,完成下列填空:
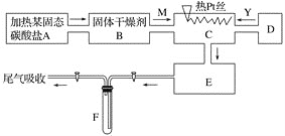
(1)A中所用装置的主要仪器和药品是______________________。
(2)B中所选的干燥剂是________,其作用是______________________________。
(3)C中发生的主要反应的化学方程式:________________________________。
(4)制取Y气体的D装置所用的主要仪器是__________________________。
制取Y气体的化学方程式是________________________。
(5)F中发生反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物:①Na2O2、②Fe(OH)3、③FeCl2、④CuS、⑤H2SiO3、⑥NaHCO3,其中不能通过化合反应制得的有几项?
A. 一项 B. 二项 C. 三项 D. 四项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是

A. 通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中
B. 吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H++O2↑
C. 步骤a的操作包括过滤、洗涤和干燥
D. 工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下2H2O(g) ![]() 2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
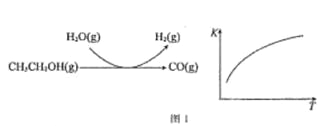
(2)乙醇水蒸气重整制氢
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图 1 所示。某温度下,图 1 所示反应每生成1mol H2(g),热量变化是 62 kJ,则该反应的热化学方程式为________________
(3)水煤气法制氢
CO(g)+ H2O(g) ![]() CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
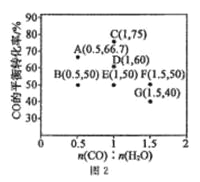
①向 2 L 恒温恒容密闭容器中加入一定量的 CO 和 0.1mol H2O(g),在图中 G 点对应温度下,反应经5 min 达到平衡,则平均反应速率 v(CO)=___________。
②图中 B、E 两点对应的反应温度分别为 TB 和 TE,则 TB ___________TE (填“>”“ <”或“=”)。
③经分析,A、E、G 三点对应的反应温度都相同(均为 T℃),其原因是 A、E、G 三点对应的 _______相同。
④当 T℃时,若向一容积可变的密闭容器中同时充入 3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2 和xmol H2,使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(4)光电化学分解制氢

反应原理如图3,钛酸锶光电极的电极反应式为 4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为 ________。
(5)Mg,Cu 是一种储氢合金
350℃时,Mg、Cu 与 H2 反应,生成 MgCu2 和仅含一种金属元素的氢化物(其中氢的质量分数约为 7.7%)。该反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列反应方程式:
①CH3-CH2-Br与氢氧化钠溶液在加热条件下的反应方程式 ___________________________________。
②乙醛与银氨溶液水浴加热条件下的反应方程式___________________________________。
③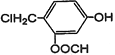 与NaOH溶液在加热条件下的化学反应方程式___________________________________。
与NaOH溶液在加热条件下的化学反应方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】㈠乳酸是一种体内代谢物,其结构简式为CH3﹣CH(OH)﹣COOH,试回答:
(1)乳酸分子中含有的官能团是_____ 和_____.(填名称)
(2)乳酸不能发生的反应是_____(填序号)
A.酯化反应 B.取代反应 C.加成反应 D.消去反应.
㈡300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式为:

(1)用没食子酸制造墨水主要利用了_____类化合物的性质.(填代号)
A.醇 B.酚 C.醛 D.羧酸
(2)写出没食子酸与氢氧化钠溶液共热反应的化学方程式:_______________.
㈢在①CH2=CH2 ②![]() ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是_____;(请填物质的序号,下同.);
(2)能使Br2的CCl4溶液褪色的是_____;
(3)既能发生取代反应又能发生加成反应的是_____;
(4)能与Na2CO3溶液反应的是_____;
(5)能发生酯化反应的是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬晶体是一种氧气吸收剂,化学式为[Cr(CH3COO)2]22H2O,不溶于冷水,易溶于盐酸.由于Cr2+易被氧气氧化,制备醋酸亚铬时,需在封闭体系中用锌作还原剂,先将Cr3+还原为Cr2+,再与醋酸钠溶液作用制得,其总反应为:2Cr3++Zn+4CH3COO﹣+2H2O═[Cr(CH3COO)2]22H2O+Zn2+。请回答下列问题:

(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是_______________________.
(2)实验开始前,必需进行的实验操作是________;实验开始时,打开恒压滴液漏斗的旋塞,让盐酸滴入装置2中,打开A,关闭B,目的是___________________________,反应一段时间后,保持盐酸持续滴下,关闭A,打开B,目的是__________________________________.
(3)已知其它反应物足量,实验时取用的是含溶质3.17g CrCl3溶液和1L 0.1molL﹣1的醋酸钠溶液;实验后得干燥纯净的醋酸亚铬晶体2.82g,则该实验所得产品的产率为_____%(不考虑醋酸亚铬晶体的溶解损失).
(4)为标定实验所用的CrCl3溶液,进行了如下操作:
取25.00mLCrCl3溶液于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入适量Na2O2,充分加热煮沸,稀释,加入过量的稀H2SO4至溶液呈强酸性,此时铬以Cr2O72﹣存在;再加入足量KI,密塞,摇匀,于暗处静置5分钟后,用0.25molL﹣1硫代硫酸钠溶液滴定至溶液呈淡黄色,加入l mL指示剂,滴定至终点.平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL.
已知:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O,2S2O32﹣+I2═S4O62﹣十2I﹣.
①实验所用的CrCl3溶液的物质的量浓度为_______.
②滴定过程中所用的指示剂是________.
③下列操作导致实验结果偏低的是___________.
a.移取CrCl3溶液的滴定管,水洗后未用CrCl3溶液润洗
b.盛硫代硫酸钠溶液的滴定管滴定前有气泡,滴定后无气泡
c.量取CrCl3溶液时先俯视后仰视
d.滴定终点时,盛硫代硫酸钠溶液的滴定管尖嘴外挂有一滴液珠未滴落.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com