
ЁОЬтФПЁПЫЎЪЧвЛжжживЊЕФздШЛзЪдДЃЌЪЧШЫРрРЕвдЩњДцВЛПЩЛђШБЕФЮяжЪЃЌЫЎжЪгХСгжБНггАЯьШЫЬхНЁПЕЁЃКЃЫЎЪЧШЫРрзЪдДБІПтЃЌШєАбКЃЫЎЕЛЏКЭЛЏЙЄЩњВњНсКЯЦ№РДЃЌМШПЩНтОіЕЫЎзЪдДШБЗІЕФЮЪЬтЃЌгжПЩГфЗжРћгУКЃбѓзЪдДЁЃ
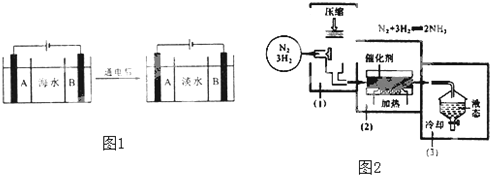
(1)ЬьШЛЫЎОЛЛЏДІРэЙ§ГЬжаашвЊМгШыЛьФ§МСЃЌГЃгУЕФЛьФ§МСгаУїЗЏЁЂСђЫсТСЁЂСђЫсЬњЕШЃЌЦфОЛЫЎзїгУЕФдРэЪЧ ______ЁЃ
(2)ЫЎЕФОЛЛЏгыШэЛЏЕФЧјБ№ЪЧЃКЫЎЕФОЛЛЏЪЧжИ ______ ЃЌЖјЫЎЕФШэЛЏЪЧжИ ______ЁЃ
(3)ФПЧАЃЌЙњМЪЩЯЪЕгУЕФЁАКЃЫЎЕЛЏЁБжївЊММЪѕжЎвЛЪЧЕчЩјЮіЗЈЃЌЭМЪЧРћгУЕчЩјЮіЗЈЖдКЃЫЎНјааЕЛЏДІРэЕФдРэЭМЁЃвбжЊКЃЫЎжаКЌ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() ЕШРызгЃЌЕчМЋЮЊЖшадЕчМЋЁЃ
ЕШРызгЃЌЕчМЋЮЊЖшадЕчМЋЁЃ
ЂйбєРызгНЛЛЛФЄ![]() жЛдЪаэбєРызгЭЈЙ§
жЛдЪаэбєРызгЭЈЙ§![]() ЪЧ ______
ЪЧ ______ ![]() ЬюЁАAЁБЛђЁАBЁБ
ЬюЁАAЁБЛђЁАBЁБ![]() ЁЃ
ЁЃ
ЂкаДГіЭЈЕчКѓбєМЋЧјЕФЕчМЋЗДгІЪН ______ ЁЃ
(4)КЃЫЎГ§СЫПЩвдЕУЕНЕЛЏЫЎжЎЭтЃЌЛЙПЩЬсШЁЖржжЛЏЙЄдСЯЃЎгЩКЃЫЎжЦБИЮоЫЎТШЛЏУОжївЊгавдЯТВНжшЃКдквЛЖЈЬѕМўЯТЭбЫЎИЩдяЃЛМгЪьЪЏЛвЃЛМгбЮЫсЃЛЙ§ТЫЃЛХЈЫѕНсОЇЁЃЦфЯШКѓЫГађе§ШЗЕФЪЧ ______ ![]() ЬюађКХ
ЬюађКХ![]() ЁЃ
ЁЃ
(5)КЃЫЎЕчНтжЦЕУЕФЧтЦјгУгкКЯГЩАБЃЌФГКЯГЩАБГЇЩњВњСїГЬЭМШчЭМЃК
ЂйЕк(1)ИіЩшБИжаЯШАб![]() КЭ
КЭ![]() бЙЫѕЕФФПЕФЪЧ ______ ЁЃ
бЙЫѕЕФФПЕФЪЧ ______ ЁЃ
ЂкдкЕк(3)ИіЩшБИжагУРфШДЗНЗЈЗжРыГі ______ ЃЌЦфФПЕФЪЧ ______ ЁЃ
ЁОД№АИЁПТСбЮЛђЬњбЮдкЫЎжаЗЂЩњЫЎНтЩњГЩЯргІЧтбѕЛЏЮяНКЬхЃЌЫќПЩЮќИНЬьШЛЫЎжааќИЁЮяВЂЦЦЛЕЬьШЛЫЎжаЕФЦфЫћДјвьЕчЕФНКЬхЃЌЪЙЦфОлГСЃЌДяЕНОЛЛЏФПЕФ гУЛьФ§МСНЋЫЎжаНКЬхМАаќИЁЮяГСЕэЯТРД Г§ШЅЫЎжа![]() КЭ
КЭ![]() B
B ![]() ЂкЂмЂлЂнЂй ЪЙЦНКтЯђЩњГЩАБЦјЕФЗНЯђвЦЖЏ вКАБ ЪЙЦНКтгввЦЃЌЬсИпЕЊЦјКЭЧтЦјЕФзЊЛЏТЪ
ЂкЂмЂлЂнЂй ЪЙЦНКтЯђЩњГЩАБЦјЕФЗНЯђвЦЖЏ вКАБ ЪЙЦНКтгввЦЃЌЬсИпЕЊЦјКЭЧтЦјЕФзЊЛЏТЪ
ЁОНтЮіЁП
(1)ТСбЮЛђЬњбЮдкЫЎжаЗЂЩњЫЎНтЩњГЩЯргІЧтбѕЛЏЮяНКЬхЃЌЮќИНЬьШЛЫЎжааќИЁЮяВЂЦЦЛЕЬьШЛЫЎжаЕФЦфЫћДјвьЕчЕФНКЬхЃЌЪЙЦфОлГСЃЌДяЕНОЛЛЏФПЕФЃЛ
(2)ЫЎЕФОЛЛЏЪЧгУЛьФ§МСНЋЫЎжаНКЬхМАаќИЁЮяГСЕэЯТРДЃЌЫЎЕФШэЛЏЪЧГ§ШЅЫЎжа![]() КЭ
КЭ![]() ЃЌНЕЕЭЫЎжаИЦЁЂУОРызгХЈЖШЁЃ
ЃЌНЕЕЭЫЎжаИЦЁЂУОРызгХЈЖШЁЃ
(3)ЂйбєРызгНЛЛЛФЄжЛдЪаэбєРызгздгЩЭЈЙ§ЃЌИєФЄBКЭвѕМЋЯрСЌЃЌбєРызгЯђвѕМЋвЦЖЏЃЌЫљвдИєФЄBЪЧбєРызгНЛЛЛФЄЃЛ
ЂкЭЈЕчКѓЃЌбєМЋЪЧТШРызгЗХЕчЃЌЩњГЩТШЦјЃЌЦфЕчМЋЗДгІЮЊЃК![]() ЃЛ
ЃЛ
(4)вђКЃЫЎжа![]() ЕФХЈЖШНЯаЁЃЌЫљвдвЊОЙ§ИЛМЏЃЌЯШМгЪьЪЏЛваЮГЩГСЕэЃК
ЕФХЈЖШНЯаЁЃЌЫљвдвЊОЙ§ИЛМЏЃЌЯШМгЪьЪЏЛваЮГЩГСЕэЃК![]() ЃЌШЛКѓНЋГСЕэЙ§ТЫЃЌМгШыбЮЫсНЋ
ЃЌШЛКѓНЋГСЕэЙ§ТЫЃЌМгШыбЮЫсНЋ![]() ГСЕэзЊЛЏЮЊ
ГСЕэзЊЛЏЮЊ![]() ЃК
ЃК![]() ЃЌетбљОЭЪЕЯжСЫ
ЃЌетбљОЭЪЕЯжСЫ![]() ИЛМЏЃЌНЋШмвКеєЗЂНсОЇЕУЕНСљЫЎКЯТШЛЏУООЇЬх
ИЛМЏЃЌНЋШмвКеєЗЂНсОЇЕУЕНСљЫЎКЯТШЛЏУООЇЬх![]() ЃЌвђ
ЃЌвђ![]() взЫЎНтЃЌЮЊЗРжЙ
взЫЎНтЃЌЮЊЗРжЙ![]() ЫЎНтЃЌМгШШСљЫЎКЯТШЛЏУООЇЬхБиаыдкHClЗеЮЇЯТжаНјааЃЌЙЪД№АИЮЊЂкЂмЂлЂнЂйЃЛ
ЫЎНтЃЌМгШШСљЫЎКЯТШЛЏУООЇЬхБиаыдкHClЗеЮЇЯТжаНјааЃЌЙЪД№АИЮЊЂкЂмЂлЂнЂйЃЛ
(5)ЂйЕк(1)ИіЩшБИжаЯШАб![]() КЭ
КЭ![]() бЙЫѕЃЌПЩЪЙбЙЧПдіДѓЃЌгаРћгк
бЙЫѕЃЌПЩЪЙбЙЧПдіДѓЃЌгаРћгк![]() ЦНКтЯђЩњГЩАБЦјЕФЗНЯђвЦЖЏЃЛ
ЦНКтЯђЩњГЩАБЦјЕФЗНЯђвЦЖЏЃЛ
ЂкдкЕк(3)ИіЩшБИжагУРфШДЗНЗЈЗжРыГівКАБЃЌЩњГЩЮяХЈЖШНЕЕЭЃЌгаРћгк![]() ЦНКтЯђе§ЯђвЦЖЏЃЌЬсИпзЊЛЏТЪЁЃ
ЦНКтЯђе§ЯђвЦЖЏЃЌЬсИпзЊЛЏТЪЁЃ


 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПеуНДѓбЇГЩЙІбажЦГіФмдкЪ§ЗжжгжЎФкНЋЕчСПГфТњЕФLi-SOCl2ЕчГиЃЌИУЕчГиЪЧЦљНёОпгазюИпФмСПБШЕФЕчГиЦфГЩБОжЛгаДЋЭГяЎЕчГиЕФвЛАыЁЃШєЕчНтвКЮЊLiAlCl4ЉSOCl2ЃЌЕчГиЕФзмЗДгІЮЊЃК4Li+2SOCl2![]() 4LiCl+S+SO2ЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
4LiCl+S+SO2ЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
A.ЗХЕчЪБЃЌИКМЋЗДгІЪНЮЊЃКLi ЈC e- = Li+
B.ШєгУИУЕчГизїЮЊЭтНгЕчдДЕчЖЦЭЃЌЕБвѕМЋжЪСПдіМг64 gЪБЃЌРэТлЩЯНЋЯћКФ14g Li
C.ЗХЕчЪБЃЌЕчНтвКжаLi+ЯђИКМЋЧЈвЦ
D.ГфЕчЪБЃЌбєМЋЗДгІЪНЮЊЃК4ClЉ+S+SO2Љ4eЉ=2SOCl2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкЗжзгЪНЮЊC4H8O2ЕФгаЛњЮяЕФЭЌЗжвьЙЙЬхЕФЫЕЗЈжаЃЌВЛе§ШЗЕФЪЧ( )
A. ЪєгкѕЅРрЕФга4жж
B. ЪєгкєШЫсРрЕФга2жж
C. МШКЌгаєЧЛљгжКЌгаШЉЛљЕФга3жж
D. ДцдкЗжзгжаКЌгаСљдЊЛЗЕФЭЌЗжвьЙЙЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇбаОПадбЇЯАаЁзщЩшМЦЪЕбщЬНОПЭЕФГЃМћЛЏбЇаджЪЃЌЙ§ГЬЩшМЦШчЯТЫљЪО
ЃЈЬсГіВТЯыЃЉ
ЮЪЬт1ЃКдкжмЦкБэжаЃЌЭгыТСЕФЮЛжУКмППНќЃЌЭВЛШчТСЛюЦУЃЌЧтбѕЛЏТСОпгаСНадЁЃФЧУДЃЌЧтбѕЛЏЭвВОпгаСНадТ№ЃП
ЮЪЬт2ЃКЬњКЭЭЖМгаБфМлЃЌвЛАуЧщПіЯТЃЌе§ЖўМлЬњЕФЮШЖЈадаЁгке§Ш§МлЬњЕФЮШЖЈадЁЃФЧУДЃЌе§вЛМлЭЕФЮШЖЈадвВаЁгке§ЖўМлЭЕФЮШЖЈадТ№ЃП
ЮЪЬт3ЃКбѕЛЏЭОпгабѕЛЏадЃЌФмБЛH2ЁЂCOЛЙдЁЃФЧУДЃЌбѕЛЏЭвВФмБЛЕЊЕФФГжжЦјЬЌЧтЛЏЮяЛЙдТ№ЃП
ЃЈЪЕбщЬНОПЃЉ
IЃЎНтОіЮЪЬт1
ЃЈ1ЃЉашгУЕНЕФвЉЦЗГ§1mol L-1 CuSO4ШмвКЁЂЯЁСђЫсЭтЃЌЛЙаш_________ЃЈЬюЪдМСЕФЛЏбЇЪНЃЉШмвКЁЃ
ЃЈ2ЃЉгУЕЈЗЏОЇЬхХфжЦ1molL-1 CuSO4ШмвК250mLЃЌбЁгУЕФвЧЦїГ§ЩеБЁЂЭаХЬЬьЦНЁЂвЉГзЁЂВЃСЇАєЁЂНКЭЗЕЮЙмЁЂСПМђЭтЃЌЛЙга________ЃЈЬювЧЦїУћГЦЃЉЁЃ
ЃЈ3ЃЉЮЊДяЕНЪЕбщФПЕФЃЌФуШЯЮЊгІНјааФФаЉЯрЙиЪЕбщЃП
ЪЕбщФкШнКЭВНжшЃКЂй_________ЃЛЂк_______________ЁЃ
ЂђЃЎНтОіЮЪЬт2
ШЁвЛЖЈСПжЦЕУЕФЧтбѕЛЏЭЙЬЬхЃЌгклсліжазЦЩеЃЌЕБЮТЖШДяЕН80ЁЋ100ЁцЪБЕУЕНКкЩЋЙЬЬхЗлФЉЃЛМЬајМгШШжС1000ЁцвдЩЯЃЌКкЩЋЗлФЉШЋВПБфГЩКьЩЋЗлФЉбѕЛЏбЧЭЃЛШЁЪЪСПКьЩЋбѕЛЏбЧЭЗлФЉгкНрЗЪдЙмжаЃЌМгШыЙ§СПЕФЯЁСђЫсЃЈЛђбЮЫсЃЉЃЌЕУЕНРЖЩЋШмвКЃЌЭЌЪБЙлВьЕНЪдЙмЕзВПЛЙгаКьЩЋЙЬЬхДцдкЁЃИљОнвдЩЯЪЕбщЯжЯѓЛиД№еЬтЃК
ЃЈ1ЃЉаДГібѕЛЏбЧЭгыЯЁСђЫсЃЈЛђбЮЫсЃЉЗДгІЕФРызгЗНГЬЪНЃК_____________ЁЃ
ЃЈ2ЃЉДгЪЕбщЂђПЩЕУГіЕФНсТлЪЧ_______________________ЁЃ
ЂѓЃЎНтОіЮЪЬт3
ЩшМЦШчЯТзАжУЃЈМаГжзАжУЮДЛГіЃЉЃК

ЕБЕЊЕФФГжжЦјЬЌЧтЛЏЮяЃЈXЃЉЛКЛКЭЈЙ§зЦШШЕФбѕЛЏЭЪБЃЌЙлВьЕНбѕЛЏЭгЩКкЩЋБфГЩСЫКьЩЋЃЌЮоЫЎCuSO4БфГЩСЫРЖЩЋЃЌЩњГЩЮяжаЛЙгавЛжжЮоЮлШОЕФЕЅжЪЦјЬхYЃЛНЋXЭЈШызЦШШЕФCuOШМЩеЙмЭъШЋЗДгІКѓЃЌЯћКФ0.01molXЃЌВтЕУBзАжУдіжи0.36gЃЌВЂЪеМЏЕН0.28gЕЅжЪЦјЬхYЁЃ
ЃЈ1ЃЉXЦјЬхЕФФІЖћжЪСПЪЧ_________________ЁЃ
ЃЈ2ЃЉCзАжУжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌЧтЗњЫсЕчРыГЃЪ§KaЃН6.8ЁС10Ѓ4molЁЄLЃ1ЃЌДзЫсЕчРыГЃЪ§KaЃН1.8ЁС10Ѓ5molЁЄLЃ1ЁЃШчЭМБэЪО25ЁцЪБЗњЛЏФЦКЭДзЫсФЦШмвКЕФХЈЖШКЭYЕФЙиЯЕЁЃдђYПЩвдБэЪОЃЈ ЃЉ

A.ШмвКЕФpHB.ЫЎНтЦНКтГЃЪ§
C.ЫЎНтАйЗжТЪD.ШмвКжавѕРызгХЈЖШжЎКЭ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШЋЪРНчУПФъИжЬњвђатЪДдьГЩДѓСПЕФЫ№ЪЇЁЃФГГЧЪаФтгУШчЭМЗНЗЈБЃЛЄТёдкЫсадЭСШРжаЕФИжжЪЙмЕРЃЌЪЙЦфУтЪмИЏЪДЁЃЙигкДЫЗНЗЈЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
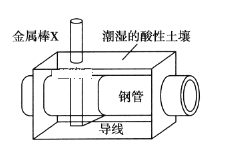
A.ЭСШРжаЕФИжЬњвзБЛИЏЪДЪЧвђЮЊдкГБЪЊЕФЭСШРжааЮГЩСЫдЕчГи
B.Н№ЪєАєXЕФВФСЯгІИУЪЧБШУОЛюЦУЕФН№Ъє
C.Н№ЪєАєXЩЯЗЂЩњЗДгІЃКMЃneЃ=MnЃЋ
D.етжжЗНЗЈГЦЮЊЮўЩќбєМЋЕФвѕМЋБЃЛЄЗЈ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП100ЁцЪБЃЌНЋ0.1 mol N2O4жУгк1 LУмБеЕФЩеЦПжаЃЌШЛКѓНЋЩеЦПЗХШы100ЁцЕФКуЮТВлжаЃЌЩеЦПФкЕФЦјЬхж№НЅБфЮЊКьзиЩЋЃКN2O4(g) ![]() 2NO2 (g)ЁЃЯТСаНсТлВЛФмЫЕУїЩЯЪіЗДгІдкИУЬѕМўЯТвбОДяЕНЗДгІЯоЖШЕФЪЧЃЈ ЃЉ
2NO2 (g)ЁЃЯТСаНсТлВЛФмЫЕУїЩЯЪіЗДгІдкИУЬѕМўЯТвбОДяЕНЗДгІЯоЖШЕФЪЧЃЈ ЃЉ
ЂйN2O4ЕФЯћКФЫйТЪгыNO2ЕФЩњГЩЫйТЪжЎБШЮЊ1ЁУ2ЃЛЂкNO2ЕФЩњГЩЫйТЪгыNO2ЯћКФЫйТЪЯрЕШЃЛЂлЩеЦПФкЦјЬхЕФбЙЧПВЛдйБфЛЏЃЛЂмЩеЦПФкЦјЬхЕФжЪСПВЛдйБфЛЏЃЛЂнNO2ЕФЮяжЪЕФСПХЈЖШВЛдйИФБфЃЛЂоЩеЦПФкЦјЬхЕФбеЩЋВЛдйМгЩюЃЛЂпЩеЦПФкЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйБфЛЏЃЛЂрЩеЦПФкЦјЬхЕФУмЖШВЛдйБфЛЏЁЃ
A. ЂкЂлЂоЂп B. ЂйЂмЂр
C. жЛгаЂйЂм D. жЛгаЂпЂр
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЯГЩАБЙЄвЕЖдЙњУёОМУКЭЩчЛсЗЂеЙОпгаживЊвтвхЃЌЖдгкУмБеШнЦїжаЕФЗДгІЃК![]()
(1)аДГіИУЗДгІЕФФцЗДгІЕФЛЏбЇЦНКтГЃЪ§БэДяЪН______ЃЌЩ§ИпЮТЖШЃЌИУЗДгІЛЏбЇЗДгІЫйТЪ______ЃЌЧтЦјЕФзЊЛЏТЪ______![]() вдЩЯОљЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБ
вдЩЯОљЬюЁАдіДѓЁБЁЂЁАМѕаЁЁБЛђЁАВЛБфЁБ![]() ЁЃЪЕМЪЩњВњжаЮТЖШвЛАуПижЦдк
ЁЃЪЕМЪЩњВњжаЮТЖШвЛАуПижЦдк![]() ЃЌдвђЪЧ______ЁЃ
ЃЌдвђЪЧ______ЁЃ
(2)ФмБэЪОИУЗДгІдкКуЮТКуШнУмБеШнЦїжа![]() ЪБПЬКѓвбОДяЕНЦНКтзДЬЌЕФЭМЪОЪЧ______ЁЃ
ЪБПЬКѓвбОДяЕНЦНКтзДЬЌЕФЭМЪОЪЧ______ЁЃ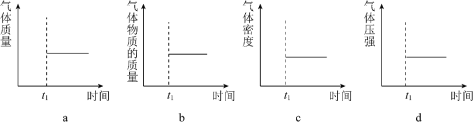
(3)ХЈЖШ![]() ЕФАБЫЎЃЌpHЮЊ
ЕФАБЫЎЃЌpHЮЊ![]() ЕБгУеєСѓЫЎЯЁЪЭ100БЖЪБЃЌдђ
ЕБгУеєСѓЫЎЯЁЪЭ100БЖЪБЃЌдђ![]() ЕФЕчРыЦНКтНЋЯђ______ЗНЯђвЦЖЏ
ЕФЕчРыЦНКтНЋЯђ______ЗНЯђвЦЖЏ![]() ЬюЁАе§ЁБЛђЁАФцЁБ
ЬюЁАе§ЁБЛђЁАФцЁБ![]() ЃЌШмвКЕФpHНЋЮЊ______
ЃЌШмвКЕФpHНЋЮЊ______![]() ЁАДѓгкЁБЁАаЁгкЁБЁАЕШгкЁБ
ЁАДѓгкЁБЁАаЁгкЁБЁАЕШгкЁБ![]() ЁЃ
ЁЃ
ЩшМЦвЛИіМђЕЅЪЕбщЃЌжЄУївЛЫЎКЯАБЪЧШѕМюЃК______ЁЃ
ФГЛЏбЇаЫШЄаЁзщНјааСЫЯТСаЙигкТШЛЏяЇЕФПЮЭтЪЕбщЃК
ЃЈЪЕбщВйзїЃЉ
![]()
НўЙ§ТШЛЏФЦШмвКЕФВМЬѕКмПьЩеЙтЃЌНўЙ§ТШЛЏяЇШмвКЕФВМЬѕВЛШМЩеЃЌУАГіАзбЬЁЃ
(4)ТШЛЏяЇБЅКЭШмвКжаРызгХЈЖШгЩДѓЕНаЁЕФЫГађЪЧ______ЁЃАзбЬЕФГЩЗжЪЧ______ЁЃ
(5)ЧыЭЦВтНўЙ§ТШЛЏяЇШмвКЕФВМЬѕВЛШМЩеЁЂВЛвззХЛ№ЕФжївЊдвђ![]() аДГівЛЬѕМДПЩ
аДГівЛЬѕМДПЩ![]() ______
______
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ10.00 mL 0.1mol/LФГЖўдЊЫсH2XШмвКжаж№ЕЮМгШы0.1mol/L NaOHШмвКЃЌЦфpHБфЛЏШчЭМЫљЪО(КіТдЮТЖШБфЛЏ)ЃЌвбжЊ:ГЃЮТЯТЃЌH2XЕФЕчРыГЃЪ§Ka1 = 1.1ЁС10-5 ЃЌKa2 = 1.3ЁС10-8ЁЃЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
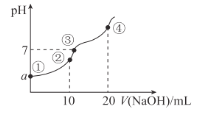
A.ДгЕуЂйЕНЕуЂмЙ§ГЬжаЫЎЕФЕчРыГЬЖШЯШдіДѓКѓМѕаЁ
B.ЕуЂкДІc(Na+) + 2c(H+) + c(H2X) =2 c(X2-) + c(HX-) + 2c(OH-)
C.aНќЫЦЕШгк3
D.ЕуЂмДІc(Na+) = 2 c(X2-) > c(OH-) > c(HX-) > c(H+)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com