
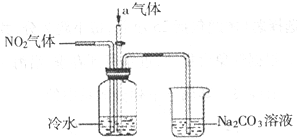
| ||
| △ |
| ||
| △ |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| 实验 编号 | KclO3(g) | 产生气体(mL) | 耗时 (s) | |||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | - | - | - | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
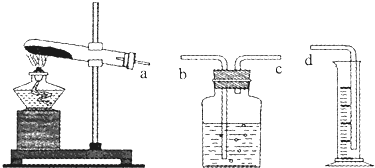
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热水瓶胆中的水垢可以用食醋除去 |
| B、可以用淀粉溶液检验加碘盐中是否含碘元素 |
| C、在蔗糖中加入浓硫酸出现黑色物质,说明浓硫酸具有脱水性 |
| D、做红烧鱼时,常加一些食醋和酒会更香,是因为生成少量的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡状态时,若c(CO)=0.100 mol?L-1,则c(CO2)=0.0263 mol?L-1 |
| B、若要提高CO的转化率,则应该加入适当的过量FeO |
| C、升高温度混合气体的平均相对分子质量不变 |
| D、若生成56gFe,则吸收的热量小于a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 结论 |
| A | 用洁净的铂金丝沾取硫酸盐在酒精灯上灼烧,焰色为黄色 | 该硫酸盐一定含Na+ 一定不含K+ |
| B | 二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体 | 酸性条件下NO3-具有强氧化性 |
| C | 在淀粉的水解液中加入新制Cu(OH)2悬浊液加热,无红色沉淀 | 淀粉没有发生水解 |
| D | 某试样溶液中加入少量稀盐酸,有白色沉淀生成 | 试样中一定含有Ag+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com