
【题目】一定温度下,在一容积固定的密闭容器中,加入1molCO2、2molH2进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),下列情况能说明反应一定达到平衡状态的是( )
CO2(g)+H2(g),下列情况能说明反应一定达到平衡状态的是( )
A.容器内混合物的相对分子质量不再随时间改变
B.生成1molH—H键的同时消耗1molCO2
C.容器内的气体总压强不再随时间改变
D.容器内CO2与H2的浓度相等
【答案】B
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A.混合气体的平均相对分子质量是混合气体的质量和混合气体的总物质的量的比值,混合气体的质量和总物质的量均始终不变,所以容器内混合气体的相对分子质量始终不变,A项错误;
B.生成1molH—H键的同时消耗![]() 说明正逆反应速率相等,反应达到平衡状态,B项正确;
说明正逆反应速率相等,反应达到平衡状态,B项正确;
C.反应前后气体体积不变,容器内的气体总压强不再随时间改变不能说明反应达到平衡状态,C项错误;
D.根据方程式可知,二氧化碳和氢气均是生成物,容器内![]() 与
与![]() 的浓度始终相等,不能说明反应达到平衡状态,D项错误;
的浓度始终相等,不能说明反应达到平衡状态,D项错误;
故答案选:B。


科目:高中化学 来源: 题型:
【题目】现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为________,碳原子和氧原子的个数比为________,该混合气体的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于可逆反应的是( )
A.氯气与水反应生成HCl与HClO
B.N2与H2在一定条件下可以生成NH3,同时NH3又可分解为N2和H2
C.电解水生成H2和O2,氢气和氧气燃烧生成H2O
D.SO2溶于水生成H2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
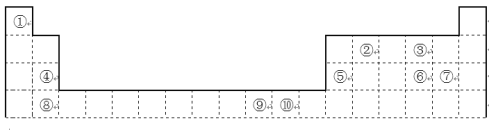
请回答下列问题:
(1)表中属于ds区的元素是(填编号)____________。
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物可用于人工降雨.有关该化合物分子的说法正确的是______。
A.分子中含极性共价键 B.含有1个σ键和2个π键 C.属于非极性分子 D.该化合物分子中,②原子采用sp2杂化
(3)根据上述表格中的十种元素填空:
I.金属性最强的主族元素是_______(填元素名称);
II.⑤、⑥、⑦的离子半径由小到大的顺序是_____(填化学式);
III.⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是____(填化学式)。
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_;该元素与元素①形成的分子X的空间构型为_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
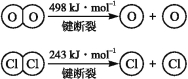
(1)反应A的热化学方程式是 。
(2)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液或熔融状态下可以导电的化合物,称为电解质 | 水中存在: |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 |
|
C | 联氨为二元弱碱,在水中的电离方式与氨相似 | 联氨与硫酸形成的酸式盐的化学式为: |
D | 发生化学反应时,接受电子对的物质为酸,提供电子对的物质为碱 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应的能量变化如下图所示。下列有关叙述正确的是
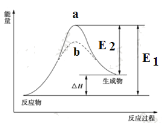
A. 该反应的焓变ΔH=E2-E1
B. a、b分别对应有催化剂和无催化剂的能量变化
C. 催化剂能改变反应的焓变
D. 催化剂能降低反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应Fe(s)+ CO2(g)![]() FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
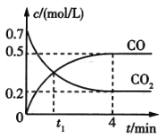
(1)t1min时,正、逆反应速率的大小关系为v正__v逆(填“>”“<”或“=”).
(2)0~4min内,CO2的转化率为__,CO的平均反应速率,v(CO)=__。
(3)下列条件的改变能减慢上述反应的反应速率的是__(填序号,下同)。
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列选项能说明上述反应已达平衡状态的是__。
①v(CO2)=v(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间的变化而变化
④容器中气体的平均相对分子质量不随时间的变化而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com