
【题目】氧化钠的摩尔质量是
A.62B.78gC.78g/molD.62g/mol
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
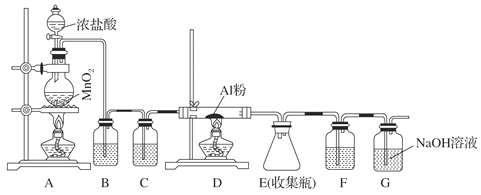
(1)其中装置A用来制备氯气,写出其离子反应方程式:_____________________________。
(2)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________________。
(3)G为尾气处理装置,其中反应的化学方程式:___________________________________。
(4)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案__________(填“可行”,“不可行”)并说明理由__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(二)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的组成、性质的说法,正确的( )
A.天然气、液化石油气的成分相同
B.葡萄糖、淀粉和乙酸乙酯在一定条件下都能发生水解反应
C.淀粉、蛋白质均属于高分子化合物,而油脂不属于高分子化合物
D.石油的裂解是化学变化,而石油的分馏和煤的干馏都是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的装置进行原电池原理的探究。下列叙述错误的是
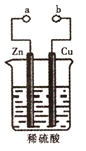
A. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
D. 无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下向2L的恒温密闭容器中投入2mol A和1mol B,发生可逆反应 3A(g)+2B(s)2C(g)+D(g)△H=﹣a kJ/mol.5min后达平衡,测得容器中n(C)=0.8mol.则下列说法正确的是( )
A.3v(A)=2v(C)=0.16 mol/(Lmin)
B.该可逆反应达平衡后,放出0.8a kJ的热能(假设化学能全转化为热能)
C.升高温度,该平衡正向速率减小,故平衡逆向移动
D.使用催化剂或缩小容器体积,该平衡均不会移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是()

A. 分子中每个原子最外层均达到8电子稳定结构
B. P4S3中硫元素为-2价,磷元素为+3价
C. 一个P4S3分子中含有三个非极性共价键
D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)已知: ![]() O2(g)═
O2(g)═ ![]() O2+(g)+
O2+(g)+ ![]() e﹣△H1=+587.9kJ/mol K1
e﹣△H1=+587.9kJ/mol K1
PtF6(g)+e﹣═PtF6﹣(g)△H2=﹣771.1kJ/mol K2
O2+PtF6﹣(s)═O2+(g)+PtF6﹣(g)△H3=+482.2kJ/mol K3
则反应O2(g)+PtF6(g)═O2+PtF6﹣(s)的△H= , K=(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示. 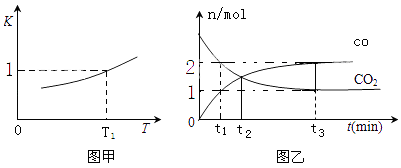
①T℃、p Pa压强下的密闭容器中进行反应,下列能说明反应达到平衡状态的是 .
a.混合气体的平均相对分子质量不再变化
b.容器内压强不再变化
c.v正(CO2)=v逆 (FeO)
d.CO2的体积分数不再变化
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2 , 达到平衡时则CO2的平衡转化率为;反应过程中体系的能量(增多或降低)
③T2温度下,恒容密闭容器中,反应过程中测定CO和CO2物质的量与时间的关系如图乙所示.则T1T2(填>、<或=),CO2的平衡转化率为 , 平衡时混合气体的密度与起始时气体的密度之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com