
【题目】(1)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:P-P:198kJ·mol-1,P-O:360 kJ·mol-1,O=O:498kJ·mol-1,则反应P4(白磷)与O2反应生成P4O6的热化学反应方程式为____。

(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJ/mol
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJ/mol
写出肼和N2O4反应的热化学方程式_____。
(3)化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。
2NH3的能量变化如图所示,该反应生成NH3(l)的热化学方程式是_____。

【答案】P4(白磷,s)+3O2(g)=P4O6(g)△H= -1638kJ/mol 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H= -1048.9kJ/mol N2(g)+3H2(g)![]() 2NH3(I) △H=2(a-b-c)kJ/mol
2NH3(I) △H=2(a-b-c)kJ/mol
【解析】
(1)白磷燃烧生成P4O6的合成方程式为P4(白磷)+3O2= P4O6,根据白磷和P4O6的分子结构,结合放出的热量=生成物的键能-反应物的键能计算;
(2)根据盖斯定律分析计算△H;
(3)根据反应热等于反应物总能量减去生成物总能量,结合图示计算反应热,并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态。
(1)白磷燃烧生成P4O6的合成方程式为P4(白磷)+3O2= P4O6,根据白磷和P4O6的分子结构,放出的热量=生成物的键能-反应物的键能=12×360kJ-[(6×198)kJ+(3×498)kJ]=1638kJ,反应的焓变是-1638kJ/mol,则反应P4(白磷)燃烧生成P4O6的热化学方程式为:P4(白磷,s)+3O2(g)=P4O6(g)△H=-1638kJ/mol;故答案为:P4(白磷,s)+3O2(g)=P4O6(g) △H=-1638kJ/mol;
(2)肼和N2O4反应的化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),①N2(g)+2O2(g)═N2O4(l) △H1═ -19.5kJmol-1,②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1,根据盖斯定律,②×2-①得到2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=(-534.2kJmol-1)×2-(-19.5kJmol-1)=-1048.9kJ/mol,故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=-1048.9kJ/mol;
(3)根据反应热等于反应物总能量减去生成物总能量计算反应热。由图可以看出,![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H=(a-b)kJ/mol,而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,所以有
H2(g)=NH3(g) △H=(a-b)kJ/mol,而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,所以有![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) △H=(a-b-c)kJ/mol,故热化学方程式为N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1,故答案为:N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1。
H2(g)=NH3(l) △H=(a-b-c)kJ/mol,故热化学方程式为N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1,故答案为:N2(g)+3H2(g)=2NH3(1) △H=2(a-b-c)kJmol-1。


科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入![]() 的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、
的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、![]() 共存体系(不考虑氯气和水的反应)。下列说法正确的是
共存体系(不考虑氯气和水的反应)。下列说法正确的是
A.若反应中转移的电子为n mol,则![]()
B.溶液中![]() 可能为
可能为![]()
C.与NaOH反应的氯气物质的量:![]()
D.当溶液中![]() 时,反应的离子方程式为:
时,反应的离子方程式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1molX、0.3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间的变化如图甲所示。图乙为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
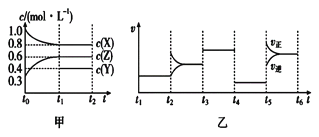
A. Y的起始物质的量为0.5mol
B. 该反应的化学方程式为2X(g)+Y(g)![]() 3Z(g) ΔH<0
3Z(g) ΔH<0
C. 若t0 =0,t1=10s,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·L-1·s-1
D. 反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是最早发现并使用青铜器的国家,后母戊鼎是我国的一级文物,是世界上出土的最大最重的青铜礼器。现代社会中铜的应用常广泛,铜的回收再利用是化工生产的一个重要领域。实验室利用废旧电池的铜帽![]() 、Zn总含量约为
、Zn总含量约为![]() 回收Cu并制备ZnO的部分实验过程如下:
回收Cu并制备ZnO的部分实验过程如下:

请回答下列问题:
(1)请写出一种加快铜帽溶解的方法:______。铜帽溶解时通入空气的作用是______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
(2)调节溶液pH时,是将溶液的pH调______![]() 填“大”或“小”
填“大”或“小”![]() 到
到![]() 。
。
(3)电解精炼粗铜时,阴极的电极反应式为______。工业上常釆用甲醇燃料电池作为电解精炼铜旳电源,写岀碱性甲醇燃料电池的负极反应式:______。
(4)已知:![]() 吋,
吋,![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 。室温下,几种离子生成氢氧化物沉淀的pH如下表所小
。室温下,几种离子生成氢氧化物沉淀的pH如下表所小![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() :
:
|
|
|
| |
开始沉淀的pH | 2 |
|
|
|
沉淀完全的pH |
|
|
|
①表中![]() 沉淀完全的pH为______。
沉淀完全的pH为______。
②由过滤粗铜的滤液制备ZnO的实验步骤依次为![]() 可选用的试剂:
可选用的试剂:![]() 、稀硝酸、
、稀硝酸、![]() 溶液
溶液![]() :
:
![]() ______;
______;
![]() ______;
______;
![]() 过滤;
过滤;
![]() ______;
______;
![]() 过滤、洗涤、干燥;
过滤、洗涤、干燥;
![]() 煅烧。
煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是一种古老而又年轻的金属元素,铜及其化合物在生产生活中有着广泛的应用。
(1)古代留下来的青铜器表面呈绿色,原因是在潮湿的空气中,铜易发生腐蚀生成铜绿,有关反应的化学方程式为______。
(2)现代工业主要采用高温冶炼黄铜矿![]() ,也可表示为
,也可表示为![]() 的方法获得铜。火法炼铜首先要焙烧黄铜矿:
的方法获得铜。火法炼铜首先要焙烧黄铜矿:![]() ,每转移0.6mol电子,有______mol硫原子被氧化。写出火法炼铜由
,每转移0.6mol电子,有______mol硫原子被氧化。写出火法炼铜由![]() 得到Cu的总方程式______。
得到Cu的总方程式______。
(3)![]() 可用于游泳池水的消毒,原因是______。
可用于游泳池水的消毒,原因是______。
(4)向![]() 和
和![]() 的混合溶液中加入CuO粉末会产生新的沉淀,该沉淀的主要成分的化学式为______(已知
的混合溶液中加入CuO粉末会产生新的沉淀,该沉淀的主要成分的化学式为______(已知![]() ,
,![]() )。
)。
(5)利用Cu和![]() 溶液的反应可制作印刷线路板,为了从含有
溶液的反应可制作印刷线路板,为了从含有![]() 、
、![]() 、
、![]() 的废液中回收Cu,某化学兴趣小组的同学设计了以下两种实验方案:
的废液中回收Cu,某化学兴趣小组的同学设计了以下两种实验方案:
方案1:向废液中加入过量铁粉,充分反应后过滤。在所得滤渣中加入足量盐酸,充分反应后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化性由强到弱的顺序为______。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时Cu已全部析出,在电极上可直接回收铜。操作比方案1简便,但方案2也有不足之处,主要表现为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中![]() 主要含
主要含![]() 、
、![]() 的
的![]() 形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:
形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:

(1)采用![]() 烟气脱硫可得到较好的效果.已知下列反应:
烟气脱硫可得到较好的效果.已知下列反应:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
则反应![]()
![]()
![]()
![]() 的
的![]() ______ .
______ .
(2)采用氨水烟气脱硫,最终可得到氮肥.将相同物质的量的![]() 与
与![]() 溶于水所得溶液中
溶于水所得溶液中![]() ______
______ ![]() 填字母编号
填字母编号![]() .
.
A.![]() /span>
/span>![]()
C.![]()
![]()
(3)烟气在较高温度经如图1方法脱除![]() ,并制得
,并制得![]() .
.
①在阴极放电的物质是 ______ .
②在阳极生成![]() 的电极反应式是 ______ .
的电极反应式是 ______ .
③已知室温下,![]() 将脱除
将脱除![]() 后制得的
后制得的![]() 配成
配成![]() 的
的![]() 溶液,与
溶液,与![]() 的
的![]() 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的![]() ,则
,则![]() 溶液与
溶液与![]() 溶液的体积比为 ______
溶液的体积比为 ______ ![]() 欲使溶液中
欲使溶液中![]() ,则应保持溶液中
,则应保持溶液中![]() ______
______ ![]() .
.
(4)一定条件下,用![]() 、NiO或
、NiO或![]() 作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:
作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:![]()
![]() 其他条件相同、催化剂不同时,
其他条件相同、催化剂不同时,![]() 的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择 ______ 为该反应的催化剂较为合理
的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择 ______ 为该反应的催化剂较为合理![]() 选填序号
选填序号![]() ;
;
![]()
![]()
![]()
选择该催化剂的理由是: ______ .
某科研小组用选择的催化剂,在![]() 时,研究了
时,研究了![]() :
:![]() 分别为1:1、3:1时,
分别为1:1、3:1时,![]() 转化率的变化情况
转化率的变化情况![]() 图
图![]() 则图3中表示
则图3中表示![]() :
:![]() :1的变化曲线为 ______ .
:1的变化曲线为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为: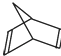
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球“最强悍”工程,“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料,有关说法正确的是
A.ETFE膜![]() 是由两种单体缩聚而成的
是由两种单体缩聚而成的
B.已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2
C.合金的熔点通常比组分金属高,硬度比组分金属小
D.用金属铝与V2O5冶炼钒,铝作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列叙述正确的是![]()
A.氢氧化铝、碳酸钠都是常见的胃酸中和剂
B.红葡萄酒密封储存时间越长质量越好原因之一是生成了有香味的酯
C.碘酒中的碘因有还原性而起到杀菌消毒作用
D.食盐、食醋、味精是常用的食品添加剂,其主要成分均属于钠盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com