
| A、4:3 | B、3:4 |
| C、2:1 | D、1:1 |
| 16x+44(1-x) |
| x+1-x |
| 4 |
| 7 |
| 4 |
| 7 |
| 3 |
| 7 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO转化为CO2的热化学方程式为2CO(g)+O2(g)═2CO2(g)△H=-566 kJ?mol-1 | ||
B、CO燃烧热的热化学方程式为CO(g)+
| ||
| C、放热反应可能需要加热才能进行,而吸热反应一定需要加热才能进行 | ||
| D、1mol H2完全燃烧生成1mol 液态水,放出的热量大于242 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸和氢氧化钠溶液反应 |
| B、氢氧化镁和盐酸反应 |
| C、澄清石灰水和硝酸反应 |
| D、氢氧化钡和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
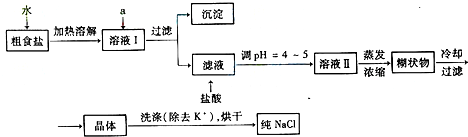
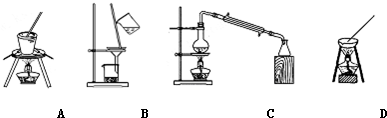
| 化学式 | CaCO3 | CaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 9.1×10-6 | 1.0×10-4 | 3.5×10-5 | 1.6×10-11 |
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
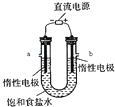
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al-Mg合金焊接过程中使用的保护气为N2 |
| B、工业上可采用电解熔融NaCl的方法制备金属钠 |
| C、将0.5molN2和1.5molH2充入一密闭容器中充分反应,放出热量19.6KJ,则该热化学方程式为N2(g)+3 H2(g)?2NH3(g)△H=-39.2 KJ?mol-1 |
| D、已知:2H2(g)+O2(g)?2H2O(g)△H=-486 KJ?mol-1,则H2的燃烧热△H为-243 KJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com