
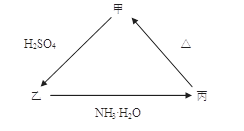
 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙 甲的化学方程式____________________。
甲的化学方程式____________________。 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。 AI2O3 + 3H2O
AI2O3 + 3H2O AI2O3 + 3H2O.(2) 若向乙溶液中加入KSCN溶液,混合溶液呈红色,说明溶液中含有Fe3+,则甲:Fe2O3;乙:Fe2(SO4)3;丙:Fe(OH)3. 甲→乙的离子方程式是Fe2O3+6H+ =2Fe3+ + 3H2O.
AI2O3 + 3H2O.(2) 若向乙溶液中加入KSCN溶液,混合溶液呈红色,说明溶液中含有Fe3+,则甲:Fe2O3;乙:Fe2(SO4)3;丙:Fe(OH)3. 甲→乙的离子方程式是Fe2O3+6H+ =2Fe3+ + 3H2O.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.先生成沉淀,后沉淀全部溶解 |
| B.当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大 |
| C.最后得到的沉淀是BaSO4 |
| D.最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
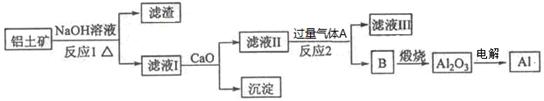
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
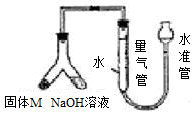
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.明矾既可以除去水中的悬浮物,也可以杀菌消毒 |
| B.可以通过电解明矾溶液来制取Al |
| C.用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高 |
| D.可以用在某溶液中加入盐酸酸化的氯化钡溶液的方法来确定该溶液中是否含有SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
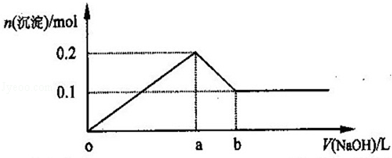
| A.NaOH的浓度为0.6mol/L |
| B.在a点处溶液中的溶质为NaCl |
| C.在b点处溶液中的溶质只有NaAlO2 |
| D.图中线段oa:ab=5:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com