
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固溶体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。
(1)基态钴原子的价电子排布图为___________。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如下图)。科学研究表明,顺式分子具有抗癌活性。

①吡啶分子是大体积平面配体,其结构简式如图所示![]() 。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
②二氯二吡啶合铂中存在的微粒间作用力有___________(填字母)。
a.范德华力 b.氢键 c.金属键 d.非极性键
③反式二氯二吡啶合铂分子是___________(填“极性分子”或“非极性分子”)。

(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如下图所示。
①“分子金属”可以导电,是因为___________能沿着其中的金属原子链流动。

②“分子金属”中,铂原子是否以sp3的方式杂化?_________(填“是”或“否”),其理由是_______。
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为dg·cm-3,则晶胞参数a=______nm(列计算式)。
【答案】![]() 11 N>Cl>C ad 非极性分子 电子 否 若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构
11 N>Cl>C ad 非极性分子 电子 否 若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构 ![]() (或
(或![]() )
)
【解析】
(1)钴为27号元素,价电子排布为3d74s2,则基态钴原子的价电子排布图为![]() ;
;
(2)①吡啶环上的原子形成6个![]() 键,还有5个C-H
键,还有5个C-H![]() 键,故每个吡啶分子中含有的
键,故每个吡啶分子中含有的![]() 键数目为11;
键数目为11;
同一周期主族元素从左到右第一电离能有增大的趋势,但由于氮原子核外p轨道处于半充满状态,第一电离能相对较高,故C、N、Cl三种元素的第一电离能由大到小的顺序是N>Cl>C;
②二氯二吡啶合铂为分子晶体,故含有范德华力;二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,Pt2+、与2个Cl-、吡啶形成配位键,没有离子键,吡啶中碳原子之间形成极性键、不同原子之间形成非极性键,C-H键中氢原子不能形成氢键,也没有金属键,故选ad项。
③反式二氯二吡啶合铂分子结构式为: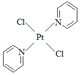 其结构对称,是非极性分子。
其结构对称,是非极性分子。
(3)①金属中不含阴阳离子,其能导电是因为电子定向移动形成电流;
②该分子为平面型的铂配合物分子,铂原子轨道不能sp3杂化。
(4)金属铂晶体中,铂原子的配位数为12,为立方晶胞,结合沿x、y或z轴的投影图,可知铂为面心立方最密堆积,Pt原子处于顶点、面心,晶胞中Pt原子数目=8![]() +6
+6![]() =4,则
=4,则![]() =d g·cm-3
=d g·cm-3![]() ,解得a=
,解得a=![]() (或
(或![]() )。
)。
(1)钴为27号元素,价电子排布为3d74s2,则基态钴原子的价电子排布图为![]() ;
;
故答案为:![]() ;
;
(2)①吡啶环上的原子形成6个![]() 键,还有5个C-H
键,还有5个C-H![]() 键,故每个吡啶分子中含有的
键,故每个吡啶分子中含有的![]() 键数目为11;
键数目为11;
同一周期主族元素从左到右第一电离能有增大的趋势,但由于氮原子核外p轨道处于半充满状态,第一电离能相对较高,故C、N、Cl三种元素的第一离能由大到小的顺序是N>Cl>C;
②二氯二吡啶合铂为分子晶体,故含有范德华力;二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,Pt2+、与2个Cl-、吡啶形成配位键,没有离子键,吡啶中碳原子之间形成极性键、不同原子之间形成非极性键,C-H键中氢原子不能形成氢键,也没有金属键,故选ad项。
③反式二氯二吡啶合铂分子结构式为: 其结构对称,是非极性分子。
其结构对称,是非极性分子。
故答案为:11;N>Cl>C;ad;非极性分子;
(3)①分子金属中不含自由移动的阴、阳离子,其能导电是因为有自由电子能沿着其中的金属原子链流动,电子定向移动形成电流;
②该分子为平面型的铂配合物分子,铂原子轨道不能sp3杂化,若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构;
故答案为:电子;否;若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构;
(4)金属铂晶体中,铂原子的配位数为12,为立方晶胞,结合沿x、y或z轴的投影图,可知铂为面心立方最密堆积,Pt原子处于顶点、面心,晶胞中Pt原子数目=8![]() +6
+6![]() =4,则晶胞的质量为
=4,则晶胞的质量为![]() =d g·cm-3
=d g·cm-3![]() ,解得a=
,解得a=![]() (或
(或![]() )。
)。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.非金属元素既可以形成阴离子,也可以形成阳离子
B.金属元素只能形成阳离子
C.互为同分异构体的两种物质物理性质不同,但化学性质相同
D.单原子核阳离子,其最外层均具有2电子或8电子的结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25.00mL 0.1mol·L-1 HSCN溶液中滴入0.1 mol·L-1 NaOH溶液,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法正确的是

A. 常温下,Ka(HSCN)约为1×10-3
B. b=25.00
C. R、Q两点溶液对应的pH=7
D. N点溶液中:c(Na+)<c(SCN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为_______mL。
(2)实验时选用的仪器有(填序号)_______。
(3)配制过程中,下列情况会使配制结果偏高的是________(填序号) 。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物的转化关系:C![]() CO2
CO2![]() H2CO3
H2CO3![]() CaCO3
CaCO3![]() CO2,其中涉及的基本反应类型依次是( )。
CO2,其中涉及的基本反应类型依次是( )。
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、复分解、分解
D.置换、化合、分解、复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com