
【题目】下列物质在水溶液中电离方程式中,书写正确的是
A. CH3COOH = H++CH3COO-
B. KHSO4 ![]() K++H++SO42-
K++H++SO42-
C. Al(OH)3![]() Al3++3OH-
Al3++3OH-
D. H3PO4 ![]() 3H++PO43-
3H++PO43-
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
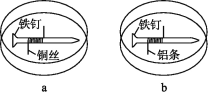
A. a中铁钉发生反应:Fe-3e-=Fe3+
B. b中铁钉上发生还原反应
C. a中铜丝上发生氧化反应:O2+2H2O+4e-=4OH-
D. b中铝条附近有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。下列判断不正确的是( )

A. 原上层液体可能是KI的水溶液,原下层液体可能是CCl4
B. 搅拌后两层液体颜色发生变化的原因是I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
C. 阴极区域pH增大的原因是水分子得电子生成了OH—
D. 阳极上的电极反应式2H++2e - =H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气(含烃类、CO、NO和SO2等)是空气的主要污染源。治理方法之一是在汽车排气管上加装“催化转化器”,使CO和NO反应产生可参与大气循环的无毒气体,促使烃类充分燃烧及SO2的转化。下列说法中错误的是
A. CO和NO反应生成CO2和N2:2CO+2NO![]() 2CO2+N2
2CO2+N2
B. 汽车改用天然气为燃料或开发氢能源,都可减少对空气的污染
C. 此方法的缺点是由于CO2的增多,会大大提高空气的酸度
D. 增大绿化面积,多植树造林,可有效控制城市空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)是一放热反应。如果反应在密闭容器中进行,下列有关说法中不正确的是( )
2NH3(g)是一放热反应。如果反应在密闭容器中进行,下列有关说法中不正确的是( )
A. 升高温度会使反应速率加快
B. 当NH3的浓度不再变化时,反应达到了平衡状态
C. 在高温和催化剂作用下,H2可以100%地转化为NH3
D. 使用催化剂可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
A. 对于反应体系 CO(g) + NO2(g) ![]() NO(g) + CO2(g),压缩体积可使颜色变深
NO(g) + CO2(g),压缩体积可使颜色变深
B. 实验室可用排饱和食盐水的方法收集氯气
C. 重铬酸钾溶液中存在如下平衡:Cr2O72-(橙红色)+H2O![]() 2H++2CrO42-(黄色),向K2Cr2O7溶液中加入几滴氢氧化钠,溶液变黄色
2H++2CrO42-(黄色),向K2Cr2O7溶液中加入几滴氢氧化钠,溶液变黄色
D. 开启啤酒瓶后,瓶中马上泛起大量泡沫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是按原子序数由小到大排列的前20号元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如右(部分产物未列出):

(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是
。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备。某研究小组探究NaCl溶液对钢铁腐蚀的影响。
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如下所示:

①实验ⅰ的现象说明,得电子的物质是_______________________________。
②碳粉的作用是___________________________________________________。
③为了说明NaCl的作用,需要补充的对照实验是_____________________。
(2)向如图示装置的烧杯a、b中各加入30mL 3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。

①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作________极。
②加热后,指针发生偏转的原因可能是_____________________。
(3)用(2)中图示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如下表所示。
实验 | a | b | 指针偏转方向 |
I | 0.1% | 0.01% | 向右 |
II | 0.1% | 3.5% | 向左 |
Ⅲ | 3.5% | 饱和溶液 | 向右 |
①Ⅱ中,b中电极发生的电极反应式是_______________________________。
②Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀。查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀。设计实验证明:_______________________________。
(4)根据上述实验,对钢铁腐蚀有影响的因素是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数,下列说法正确的是
A. 标准状况下,11.2L CCl4 中含 C—Cl 键的数目 1.5NA
B. 8.7g MnO2 与 40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为 0.1 NA
C. 1mol NaHSO4固体中含有的离子总数为 2 NA
D. 0.5mol·L-1K2SO4 溶液中,阴阳离子总数为 1.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com