
【题目】北京时间2017年10月4日,地球发生一次小行星撞击事件,撞击地点为我国云南香格里拉县城西北40公里处,爆炸当量相当于540t TNT。很可能有未燃尽的陨石落到地面。全世界已收集到4万多块陨石样品,它们大致可分为三大类:石陨石(主要成分是硅酸盐)、铁陨石(铁镍合金)、和石铁陨石(铁和硅酸盐混合物)。

回答下列问题:
(1)基态铁原子简化的电子排布式为[Ar]_______。
(2)TNT的结构简式如图所示。

①TNT分子中碳原子杂化类型是____。
②TNT的熔点比硝基苯的熔点__(填“高”或“低”),理由是___。
(3)石陨石中硅酸盐之一是Ca2SiO4。
SiO44-的立体构型是_____。电负性:Si___(填“>”“<”或“=”)O。
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有__(填字母)。
a.离子键 b.极性键 c.非极性键 d.π键 e.配位键 f.氢键
②1mol [Fe(CN)6]3含σ键数目为_____。
③CN-能与多种离子形成配合物,碳原子提供孤电子对,而不是氮原子,其原因是___。
(5)铁、氮组成磁材料M,其晶胞如图所示。该晶体中氮、铁原子个数之比为____。

(6)镍晶体的堆积方式为面心立方最密堆积。已知镍晶体密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。用含ρ和NA的代数式表示在镍晶胞中最近的两个镍原子之间的核间距D=__nm。
【答案】3d64s2 sp2、sp3 高 组成、结构相似,TNT的相对分子质量较大,分子间作用力较大 正四面体 < c、f 12NA C的原子半径大于N的,提供孤电子对的能力比N强 1∶3 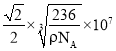
【解析】
(1)铁为26号元素,结合核外电子排布的规律分析书写基态铁原子的电子排布式;
(2)①TNT分子中存在2中碳原子:苯环上的碳原子和甲基中的碳原子,据此分析判断;②组成、结构相似的物质,相对分子质量越大,分子间作用力越强,物质的熔点越高,据此分析判断;
(3)根据价层电子对个数=σ键个数+![]() (a-xb)分析判断SiO44-的立体构型;元素的非金属性越强,电负性越大;
(a-xb)分析判断SiO44-的立体构型;元素的非金属性越强,电负性越大;
(4)①K3[Fe(CN)6](铁氰化钾)中存在离子键、配位键和极性共价键,![]() 中还存在π键;②
中还存在π键;②![]() 中存在2个π键,1个σ键,配位键是σ键;③配位原子需要具备两个条件:一是有孤电子对,二是原子半径较大,容易提供孤电子对,据此分析解答;
中存在2个π键,1个σ键,配位键是σ键;③配位原子需要具备两个条件:一是有孤电子对,二是原子半径较大,容易提供孤电子对,据此分析解答;
(5)M晶胞是六方最密堆积,顶点贡献率为![]() ,面心贡献率为
,面心贡献率为![]() ,结合均摊法分析解答;
,结合均摊法分析解答;
(6)根据均摊法计算镍原子数,面心立方晶胞中面对角线上3个镍原子相切,面对角线长度等于镍原子半径的4倍,据此分析解答。
(1)铁为26号元素,基态铁原子简化的电子排布式为[Ar] 3d64s2,故答案为:3d64s2;
(2)①TNT分子中苯环上的碳原子采用sp2杂化,甲基中的碳原子采用sp3杂化,故答案为:sp2、sp3;
②组成、结构相似的物质,相对分子质量越大,分子间作用力越强,物质的熔点越高,TNT的相对分子质量较大,分子间作用力较大,因此TNT的熔点比硝基苯的熔点高,故答案为:高;组成、结构相似,TNT的相对分子质量较大,分子间作用力较大;
(3)SiO44-中Si的价层电子对数=4+![]() =4,没有孤电子对,立体构型为正四面体。O的非金属性比硅强,因此电负性:Si<O,故答案为:正四面体;<;
=4,没有孤电子对,立体构型为正四面体。O的非金属性比硅强,因此电负性:Si<O,故答案为:正四面体;<;
(4)①K3[Fe(CN)6](铁氰化钾)中存在离子键、配位键和极性共价键,![]() 中还存在π键,不存在非极性键和氢键,故答案为:c、f;
中还存在π键,不存在非极性键和氢键,故答案为:c、f;
②![]() 中存在2个π键,1个σ键,配位键是σ键,故1mol [Fe(CN)6]3含σ键12mol,数目为12NA,故答案为:12NA;
中存在2个π键,1个σ键,配位键是σ键,故1mol [Fe(CN)6]3含σ键12mol,数目为12NA,故答案为:12NA;
③配位原子需要具备两个条件:一是有孤电子对,二是原子半径较大,容易提供孤电子对。C的原子半径大于N的,提供孤电子对的能力比N强,因此形成配位键时,CN-中碳原子提供孤电子对,而不是氮原子,故答案为:C的原子半径大于N的,提供孤电子对的能力比N强;
(5)M晶胞是六方最密堆积,顶点贡献率为![]() ,面心贡献率为
,面心贡献率为![]() ,1个M晶胞含有2个N原子,铁原子数=12×
,1个M晶胞含有2个N原子,铁原子数=12×![]() +2×
+2×![]() +3=6,该晶体中氮、铁原子个数之为2∶6=1∶3,故答案为:1∶3;
+3=6,该晶体中氮、铁原子个数之为2∶6=1∶3,故答案为:1∶3;
(6)面心立方晶胞中含有镍原子数=8×![]() +6×
+6×![]() =4,晶胞中面对角线上3个镍原子相切,面对角线长度等于镍原子半径的4倍。1cm=1×107nm,设镍晶胞的边长为x,则ρ=
=4,晶胞中面对角线上3个镍原子相切,面对角线长度等于镍原子半径的4倍。1cm=1×107nm,设镍晶胞的边长为x,则ρ=![]() ,x=
,x=![]() cm=
cm=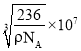 nm,(2D)2=x2,D=
nm,(2D)2=x2,D=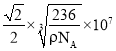 nm,故答案为:
nm,故答案为: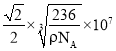 。
。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质能使带火星的木条复燃,q的水溶液呈碱性。0.0l mol·L-l s溶液的pH为12,q、s的焰色反应均呈黄色。
上述物质的转化关系如图所示。下列说法正确的是
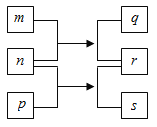
A. 原子半径:w<x<Y<z
B. 通常状况下,X的氢化物可能呈气态、液态或固态
C. Y的氢化物的沸点比Z的氧物的沸点高
D. 由W、X、Y、Z四种元素只能组成一种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mLcmol·L-1KOH溶液中滴加0.1mol·L-1HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
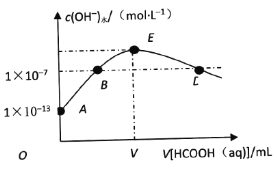
A. 上述KOH溶液的浓度c=0.01mol·L-1
B. B点对应的溶液中:c(K+)=c(HCOO-)
C. E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH)
D. 若D点对应的甲酸溶液体积为V1mL,则HCOOH电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A.b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.图中b、c、d三点溶液中水的电离程度最大的是c点
C.b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D.pH=7时,溶液中c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、Cu2+、CO32—、SO42—、NO3—中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法错误的是
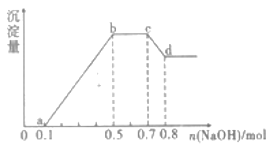
A. 溶液中的阳离子有H+、Mg2+、Al3+、NH4+
B. cd段的离子方程式为Al(OH)3+OH—=AlO2—+2H2O
C. 溶液中n(NH4+)=0.2mol
D. n(H+):n(Mg2+):n(Al3+)=1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4=Cu+FeSO4
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4 =BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)反应①中,氧化剂是______________________。
(2)反应③的离子反应方程式为_________________________________________。
(3)写出一个符合⑧的化学反应方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液中,产物中可能含有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
的值与温度高低有关。当n(KOH)=a mol时,下列说法不正确的是
A.参加反应的氯气的物质的量等于![]() a mol
a mol
B.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量n(e-)的范围为![]() a mol≤n(e-)≤
a mol≤n(e-)≤![]() a mol
a mol
D.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列各溶液中,下列有关说法正确的是
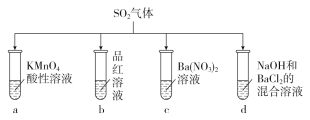
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,说明SO2具有还原性
D. 试管d中能产生白色沉淀,加入稀硝酸后沉淀完全溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com