
����Ŀ������������ⶪ�����������ˮ������Ⱦ������к��е��ؽ������Ӷ�ֲ�������ж������ã��������廹���˺��˵���ϸ�������Ρ����������ȵȡ�ijͬѧ����һЩ�����ﳣ���µ��ܶȻ��������±���
���� | FeS | CuS(��ɫ) | MnS(��ɫ) | PbS | HgS | ZnS |
Ksp |
|
|
|
|
|
|
���� | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Pb(OH)2 | Zn(OH)2 | |
Ksp |
|
|
|
|
|
(1)��ͬѧ�ں�����ͬŨ��Mn2+��Cu2+����Һ�еμ�Na2S��ϡ��Һ���۲쵽�ȳ��ֵij�����ɫ��______����ʵ��˵������ͬ������KspԽС�����ʵ��ܽ��____(����Խ��������ԽС��)��
(2)��֪�����������ӿ�ʼ������pHΪ1.0�������Һ�� Fe3+�����ʵ���Ũ��Ϊ______������Һ�к�����Fe3+��Ũ�ȵ� Al3+������ pH ʹ Fe3+������ȫʱ������_____Al(OH)3����(����������������������)��
(3)ij��ҵ��ˮ�к���Cu2+��Pb2+��Hg2+���ʣ����ó���ת��ԭ�������˼��������__________(�����)��д��������Լ���ȥPb2+ʱ���������ӷ�Ӧ����ʽ_______��
A.FeS B.Fe2O3 C.Na2S D.ZnO
(4)�� FeCl3��6H2O����õ�������ˮFeCl3����Ҫ���еIJ�����_________��
���𰸡���ɫ ԽС 2.6 mol/L ���� C Pb2++S2-=PbS�� ��HCl�����м���
��������
��1��ͬ���ͳ�����KspԽС���ܽ��ԽС��Խ����������
��2������Fe��OH��3���ܶȻ���������c��Fe3+��������Al��OH��3��Ksp���������ж��Ƿ���Al��OH��3������
��3�������Լ�Ӧ������Ϊ������������µ����ʣ���ü��������Ե����ʺ�ת��Ϊ�����ܵ����ʣ�
��4���Ȼ�����������ˮ�����������������ò����������Ȼ�����Ӧ���Ȼ��������м���ʧȥ�ᾧˮ��
��1������ͬ������KspԽС�����ʵ��ܽ��ԽС������ں�����ͬŨ��Mn2+��Cu2+����Һ�еμ�Na2S��ϡ��Һ���۲쵽�ȳ��ֵij����Ǻ�ɫ��CuS��
��2����ʼ����ʱ����Һ��Qc=Ksp�������ӿ�ʼ������pHΪ1.0��
���ʱ��Һ��![]() ��
��
�����Һ�� Fe3+�����ʵ���Ũ��Ϊ![]() ��
��
Fe3+������ȫʱ����Һ�����������ӵ�Ũ��Ϊ![]() ��
��
����Һ��pHԼΪ3��
�����ӿ�ʼ����ʱ��Һ�����������ӵ�Ũ��Ϊ![]() ��
��
��Һ��pHԼΪ3��
���Fe3+������ȫ�������ӿ�ʼ����ʱpH������ͬ��ʹ Fe3+������ȫʱ�����к���Al(OH)3������
��3��ij��ҵ��ˮ�к���Cu2+��Pb2+��Hg2+���ʣ����ó���ת��ԭ�������˼��������Na2S����ȥPb2+ʱ���������ӷ�Ӧ����ʽΪPb2++S2-=PbS����
��4���� FeCl3��6H2O����õ�������ˮFeCl3��Ҫ����FeCl3��ˮ�⣬���Ҫ���еIJ���Ϊ��HCl�����м��ȡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H��һ�ְ����ᣬ��ϳ�·�����£�

��֪��
��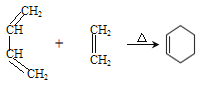
��RMgBr RCH2CH2OH+
RCH2CH2OH+![]()
��R-CHO![]()
![]()
![]()
![]()
���������գ�
��1��A�ķ���ʽΪC3H4O����ṹ��ʽΪ____________��
��2��E��F�Ļ�ѧ����ʽΪ____________��
��3��H�Ľṹ��ʽΪ_________________��д���������������ı�������ͬ���칹��Ľṹ��______________��________________��
I.���б�����II.�����������ֲ�ͬ��������ԭ�ӡ�
��4��������������Ϣ�����һ����CH2Cl2�ͻ������飨![]() ���Ʊ�1��4-���ϩ�ĺϳ�·�ߣ����Լ���ѡ����___________�����ϳ�·�߳��õı�ʾ��ʽΪ��A
���Ʊ�1��4-���ϩ�ĺϳ�·�ߣ����Լ���ѡ����___________�����ϳ�·�߳��õı�ʾ��ʽΪ��A![]() B����
B����![]() Ŀ����
Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��CO2�����״��������仯ʾ��ͼ������˵����ȷ���ǣ� ��
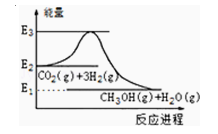
A��E2_E1�Ǹ÷�Ӧ����ЧӦ
B��E3_E1�Ǹ÷�Ӧ����ЧӦ
C���÷�Ӧ���ȣ��ڳ��³�ѹ�¾��ܽ���
D��ʵ�ֱ��Ϊ��������Ч��������ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����( )
A.1 L pH=1��H2SO4��Һ�к���0.1 NA��H+
B.��ȡ1 L���ʵ���Ũ�Ⱦ�Ϊ0.1 mol/L�������ƺ�������Һ�����ж�����0.1 NA��PO43��
C.�����£�0.01 mol/L CH3COONH4,��Һ��pH=7��1 L����Һ�к���NH4+��Ŀ��0.01 NA
D.��0.01 mol��AlCl3����ˮ�������γɽ��壬���ý��������Ϊ0.01 mol Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽��SO2����ˮ��Ư���ԣ����������ʵ�飬װ����ͼ�����������գ�
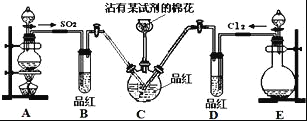
��1������մ�е��Լ���NaOH��Һ��������______��
��2���ٷ�Ӧ��ʼһ��ʱ���B��D�����Թ��п��Թ۲쵽������ֱ��ǣ�B��_____��D��____��
��ֹͣͨ���ֱ����B��D�����Թܣ����Թ۲쵽������ֱ��ǣ�B��_____��D��____��
��3����ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�������Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������룮�����������ԭ���û�ѧ����ʽ��ʾ��______��
��4��װ��E����_____���ѧʽ����Ũ���ᷴӦ�Ƶ�Cl2������2.24L����״������Cl2����������HClΪ____mol��
��5��ʵ���������պ���Լ���������SO42����ʵ�鷽���ǣ�ȡ���е�Һ���������μ�������ϡHNO3���ټ��뼸��BaCl2��Һ�����ְ�ɫ�������÷����Ƿ����____��������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������˶�Ա�����˷ܼ������ҹ�֧�������İ���������Ҫ���֡�ij���˷ܼ��Ľṹ��ʽ��ͼ��ʾ���йظ����ʼ�����Һ��˵���������
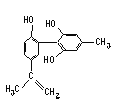
A.�÷�����������ԭ�Ӳ�������ͬһ��ƽ����
B.1 mol��������H2��Ӧʱ���������7 molH2
C.����FeCl3��Һ����ɫ����Ϊ���������ڷ�������
D.�������Ը��������Һ����ɫ��ȥ����֤����ṹ�д���̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ�ӽṹ��˵������ȷ����
A.¬ɪ������![]() ����ɢ��������������Ѹ����ʽ����ԭ�ӽṹģ��
����ɢ��������������Ѹ����ʽ����ԭ�ӽṹģ��
B.ԭ���У��˶Ժ��������������ʵ���Ǻ��ڵ����ӶԺ�����ӵ�����
C.����������Ԫ�ص����࣬�������������ص�����
D.���е�ԭ�Ӷ��������ӡ����Ӻ͵���3�ֻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����������գ�
��1�������������ʽ��ʾ![]() �����Ϊ_____��
�����Ϊ_____��
��2��þ�������ˮ�з�Ӧ�Ļ�ѧ����ʽΪ___��
��3����ҵ��������ʯ����Ϊԭ������Ư�۵Ļ�ѧ����ʽΪ_____��
��4�������ڵ�![]() ��ֻ��2�����ӣ����뷽��ʽΪ___��
��ֻ��2�����ӣ����뷽��ʽΪ___��
��5��������������ͨ����ˮ�У���Ӧ�����ӷ���ʽΪ_____��
��6����Ӧ![]() �У��������뱻��ԭ����ԭ�ӵ���Ŀ��Ϊ_____��
�У��������뱻��ԭ����ԭ�ӵ���Ŀ��Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��B������C��Hԭ�Ӹ�����Ϊ1�U2����Է�������Ϊ28���˴Ź���������ʾ������ֻ��һ�ֻ�ѧ��������ԭ�ӣ��������µ�ת����ϵ��
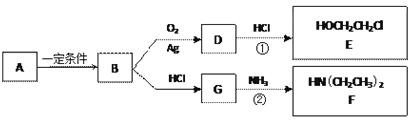
��1��B�Ľṹ��ʽ��_________________
��2��A��������������������___________
a���� b��±���� c���� d������
��3����Ӧ����D��HCl�����ʵ���֮��1�U1�ļӳɷ�Ӧ����D�ķ���ʽ��___________��
��Ӧ���ɱ�ʾΪ��G + NH3�� F + HCl (δ��ƽ)���÷�Ӧ��ƽ��Ļ�ѧ����ʽ�ǣ��л���������ýṹ��ʽ��ʾ���� ____________________________________
������E��HOCH2CH2Cl���� F [ HN(CH2CH3)2 ]��ҩƷ��³����ϳɵ���Ҫ�м��壬��³����ĺϳ�·�����£�����֪��![]() ��
��

��4���Ľṹ��ʽ�� _________________��
�ɼױ����ɼķ�Ӧ������_________________��
��5�����������ֺ��������ţ���Ӧ���Ļ�ѧ����ʽ��___________________________________
��6�����й����ŵ�������_______________________________________��
��7����³����������ˮ����ﶡ���졣
�� �����Ϊͬ���칹�壬��Ľṹ��ʽ��_____________________��
�� �쾭�ۺϷ�Ӧ�Ƴɵĸ߷�����ά�㷺����ͨѶ��������þۺϷ�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
�� D�ĺ�����ױ��������ڳ�C��H����C��C�����������C��O��������D��F��һ�������·�Ӧ���ɶ��Ļ�ѧ����ʽ��________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com