
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 L pH=1的H2SO4溶液中含有0.1 NA个H+
B.各取1 L物质的量浓度均为0.1 mol/L的磷酸钠和磷酸溶液,其中都含有0.1 NA个PO43—
C.室温下,0.01 mol/L CH3COONH4,溶液的pH=7,1 L该溶液中含有NH4+数目有0.01 NA
D.将0.01 mol的AlCl3溶于水并加热形成胶体,所得胶粒数最多为0.01 mol Al(OH)3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和______________。(填序号)
a.瓷坩埚 b.蒸发皿 c.铁坩埚 d.泥三角
(2)在“加酸岐化”时不宜用硫酸的原因是__________;不宜用盐酸的原因是____________。反应之后得到高锰酸钾的步骤是:过滤、蒸发结晶、趁热过滤。该步骤能够得到高锰酸钾的原理是____________。
(3)采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O![]() 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为_________________。
(4)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知涉及到的反应:
Na2C2O4+H2SO4=H2C2O4(草酸)+Na2SO4 ,
5H2C2O4+ 2MnO4—+6H+=2Mn2++10CO2↑+ 8H2O
Na2C2O4的式量:134 KMnO4的式量:158)
Ⅰ.称取0.80 g 的高锰酸钾产品,配成50mL溶液。
Ⅱ.称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ.将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL。
a.判断达到滴定终点的标志是____________________________。
b.样品中高锰酸钾的质量分数为______________(保留3位小数)。
c.加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度__________。(填“偏高”、“偏低”或“无影响”)
d.将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,其原因可能为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用稀HNO3和Cu制取少量NO并验证氮氧化合物性质的装置.下列说法错误的是( )

A.吸收剂可以是NaOH溶液B.试管上部的气体始终为无色
C.小试管中溶液最终呈蓝色D.试纸先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为Na2SO4+2C![]() Na2S+2CO2↑。其主要流程如下:
Na2S+2CO2↑。其主要流程如下:

(1) Na2S溶液显碱性,写出相关反应的方程式(主要)______,上述流程中采用稀碱液比用热水更好,理由是___________。
(2)常温下,等体积、等物质的量浓度的NaHS溶液与Na2S溶液混合,混合溶液中c(S2-)_____c(HS-) (填“大于”、“小于”或“等于”)。若混合溶液的pH=10,则c(HS-)+3c(H2S)-c(S2-)= ___________________
(3)已知:I2+2S2O32-=2I-+S4O62-。上述所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1I2溶液滴定至终点,用去5.00mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向两支盛有2 mL相同浓度银氨溶液的试管中滴加2滴相同浓度的NaCl和NaI溶液 | 一支产生黄色沉淀,另一只无明显现象 | Ksp(AgI)<Ksp(AgCl) |
B | 向10 mL 0.1 mol/L AgNO3溶液中滴加2滴0.01 mol/L NaBr溶液,再滴加2滴0.01 mol/ LNa2S溶液 | 先产生浅黄色沉淀,然后出现黑色沉淀 | Ksp(AgBr)>Ksp(Ag2S) |
C | 向盛有2 mL 0.1 mol/L MgCl2溶液的试管中先滴加2滴2 mol/L NaOH溶液,再滴加2滴0.01 mol/L CuCl2溶液 | 先产生白色沉淀,然后白色沉淀变蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
D | 将H2S通人浓度均为0.01 mol/L的ZnSO4和CuSO4混合液中 | 先产生黑色的CuS沉淀 | Ksp(ZnS)>Ksp(CuS) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃电池随意丢弃会对土壤或水产生污染,电池中含有的重金属离子对植物生长有毒害作用,摄人人体还会伤害人的脑细胞、神经、肝、肾、骨骼等等。某同学查阅一些难溶物常温下的溶度积常数如下表:
物质 | FeS | CuS(黑色) | MnS(红色) | PbS | HgS | ZnS |
Ksp |
|
|
|
|
|
|
物质 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Pb(OH)2 | Zn(OH)2 | |
Ksp |
|
|
|
|
|
(1)该同学在含有相同浓度Mn2+和Cu2+的溶液中滴加Na2S的稀溶液,观察到先出现的沉淀颜色是______,该实验说明在相同条件下Ksp越小,物质的溶解度____(填“越大”或“越小”)。
(2)已知室温下铁离子开始沉淀的pH为1.0,则此溶液中 Fe3+的物质的量浓度为______,若溶液中含有与Fe3+等浓度的 Al3+,调节 pH 使 Fe3+沉淀完全时,其中_____Al(OH)3沉淀(填“含有”或“不含有”)。
(3)某工业废水中含有Cu2+、Pb2+、Hg2+杂质,利用沉淀转化原理最适宜加入过量的__________(填序号)。写出加入该试剂除去Pb2+时发生的离子反应方程式_______。
A.FeS B.Fe2O3 C.Na2S D.ZnO
(4)由 FeCl3·6H2O晶体得到纯的无水FeCl3,需要进行的操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浩瀚的海洋里蕴藏着丰富的化学资源。利用海水可以提取溴和镁,提取过程如下:
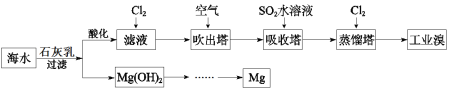
(1)氯元素在周期表中的位置是___。
(2)提取溴的过程中,经过2次Br-→Br2转化的目的是___。
(3)吸收塔中发生反应的离子方程式是___。
(4)结合平衡移动原理解释加石灰乳的作用___。
(5)用原子结构知识解释Na的金属性强于Mg的原因___。
(6)工业上常用上述流程“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36gBr2,若提取率为60%,则原海水中溴的浓度为___mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】破坏(或形成)1 mol化学键所吸收(或放出)的能量称为键能。已知 H—H 键的键能为 436 kJ·mol-1,O=O键的键能为 498 kJ·mol-1, H2(g)+![]() O2(g)=H2O(l) ΔH=-286 kJ·mol-1 , 则 H2O 分子中 O—H 键的键能为( )
O2(g)=H2O(l) ΔH=-286 kJ·mol-1 , 则 H2O 分子中 O—H 键的键能为( )
A.485.5 kJ·mol-1 B.610 kJ·mol-1 C.917 kJ·mol-1 D.1 220 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com