
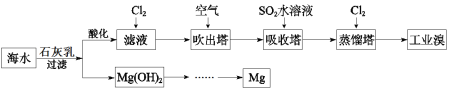
����Ŀ����嫵ĺ������̲��ŷḻ�Ļ�ѧ��Դ�����ú�ˮ������ȡ���þ����ȡ�������£�
��1����Ԫ�������ڱ��е�λ����___��
��2����ȡ��Ĺ����У�����2��Br-��Br2ת����Ŀ����___��
��3���������з�����Ӧ�����ӷ���ʽ��___��
��4�����ƽ���ƶ�ԭ�����ͼ�ʯ���������___��
��5����ԭ�ӽṹ֪ʶ����Na�Ľ�����ǿ��Mg��ԭ��___��
��6����ҵ�ϳ�������������������������ʵ�ֺ�ˮ���壬��1m3��ˮŨ����1L��ʹ�ø÷����յõ�36gBr2������ȡ��Ϊ60%����ԭ��ˮ�����Ũ��Ϊ___mg/L��
���𰸡���������VIIA�� ������Ԫ�� SO2+2H2O+Br2=4H++2Br-+SO42- Ca(OH)2+Mg2+![]() Mg(OH)2+Ca2+��Mg(OH)2�ܽ��С��Ca(OH)2��ƽ�����ƣ���Mg2+ת��ΪMg(OH)2���� Na��Mg��Ϊ��������Ԫ�أ�Na���������1�����ӣ�Mg���������2�����ӣ�Na������ʧȥ���ӣ�����Na�Ľ�����ǿ��Mg 120
Mg(OH)2+Ca2+��Mg(OH)2�ܽ��С��Ca(OH)2��ƽ�����ƣ���Mg2+ת��ΪMg(OH)2���� Na��Mg��Ϊ��������Ԫ�أ�Na���������1�����ӣ�Mg���������2�����ӣ�Na������ʧȥ���ӣ�����Na�Ľ�����ǿ��Mg 120
��������
������ʾΪ��ˮ��Դ���ۺ����ã���ˮ�м���ʯ���飬�õ�������þ������ĸҺ����������þ��������һϵ�еIJ��������ջ�õ�����þ������ĸҺ�ữ����������Br�D������Ȼ�����ȿ�������������Br2������������SO2���仹ԭ�����������ã���������������������õ��嵥�ʡ�
��1����Ԫ�������ڱ��е�λ���ǵ�������VIIA�壻
��2�����ݷ�������֪��ȡ��Ĺ����У�����2��Br-��Br2ת����Ŀ���Ǹ�����Ԫ�أ�
��3���������з�����ӦSO2��Br2��ԭ�����ӷ���ʽ��SO2+2H2O+Br2=4H++2Br-+SO42-��
��4��ʯ����Ϊ�������Ƶ�����Һ��Ca(OH)2+Mg2+![]() Mg(OH)2+Ca2+��Mg(OH)2�ܽ��С��Ca(OH)2��ƽ�����ƣ���Mg2+ת��ΪMg(OH)2������
Mg(OH)2+Ca2+��Mg(OH)2�ܽ��С��Ca(OH)2��ƽ�����ƣ���Mg2+ת��ΪMg(OH)2������
��5��Na��Mg��Ϊ��������Ԫ�أ�Na���������1�����ӣ�Mg���������2�����ӣ�Na������ʧȥ���ӣ�����Na�Ľ�����ǿ��Mg��
��6��ʹ�ø÷����յõ�36gBr2����Brԭ�ӵ�����Ϊ72g����ȡ��Ϊ60%��ԭ��ˮ�е�Brԭ�ӵ�����Ϊ72g��60%=120g����ԭ��ˮ�����Ũ��Ϊ120��1000mg��1000L=120mg/L


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������
(1)������һ�ֿɷ�����硢�ŵ��װ�á���һ�������ڳ��ͷŵ�ʱ�����ķ�Ӧ���£�NiO2+Fe+2H2O![]() Fe(OH2+Ni(OH)2��
Fe(OH2+Ni(OH)2��
�ٴ������ڳ��ʱ����ظ���Ӧ����ӵ�Դ��___�����ӣ��缫��ӦʽΪ____��
�ڷŵ�ʱ����Ni(OH)2��һ�����ڳ��ʱ����___(������������ԭ��)��Ӧ��
(2)����ͼ��ʾװ�ý������в�ͬ�IJ�����
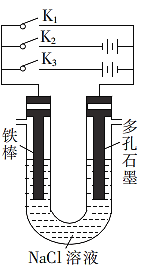
��K1��K2��K3��ֻ�ر�һ���������ĸ�ʴ����������ֻ�պ�___(����K1����K2������K3������ͬ)ʱ��Ϊ�������ĸ�ʴ��Ӧֻ__�պϣ��÷�������Ϊ___
��ֻ�պ�K1����������������5.6gʱ��ʯī�缫���ĵ��������Ϊ_____L(��״��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����( )
A.1 L pH=1��H2SO4��Һ�к���0.1 NA��H+
B.��ȡ1 L���ʵ���Ũ�Ⱦ�Ϊ0.1 mol/L�������ƺ�������Һ�����ж�����0.1 NA��PO43��
C.�����£�0.01 mol/L CH3COONH4,��Һ��pH=7��1 L����Һ�к���NH4+��Ŀ��0.01 NA
D.��0.01 mol��AlCl3����ˮ�������γɽ��壬���ý��������Ϊ0.01 mol Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������˶�Ա�����˷ܼ������ҹ�֧�������İ���������Ҫ���֡�ij���˷ܼ��Ľṹ��ʽ��ͼ��ʾ���йظ����ʼ�����Һ��˵���������
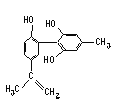
A.�÷�����������ԭ�Ӳ�������ͬһ��ƽ����
B.1 mol��������H2��Ӧʱ���������7 molH2
C.����FeCl3��Һ����ɫ����Ϊ���������ڷ�������
D.�������Ը��������Һ����ɫ��ȥ����֤����ṹ�д���̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ�ӽṹ��˵������ȷ����
A.¬ɪ������![]() ����ɢ��������������Ѹ����ʽ����ԭ�ӽṹģ��
����ɢ��������������Ѹ����ʽ����ԭ�ӽṹģ��
B.ԭ���У��˶Ժ��������������ʵ���Ǻ��ڵ����ӶԺ�����ӵ�����
C.����������Ԫ�ص����࣬�������������ص�����
D.���е�ԭ�Ӷ��������ӡ����Ӻ͵���3�ֻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.![]() ��CO�Ļ���ﹲ
��CO�Ļ���ﹲ![]() ������̼ԭ�ӵ���ĿΪNA
������̼ԭ�ӵ���ĿΪNA
B.![]() ��ˮ
��ˮ![]() �����к��е�������Ϊ0.8NA
�����к��е�������Ϊ0.8NA
C.![]() ���������98%Ũ
���������98%Ũ![]() �У�ת�Ƶ�����Ϊ3NA
�У�ת�Ƶ�����Ϊ3NA
D.![]()
![]() ��NaCl��Һ����������0.5NA
��NaCl��Һ����������0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����������գ�
��1�������������ʽ��ʾ![]() �����Ϊ_____��
�����Ϊ_____��
��2��þ�������ˮ�з�Ӧ�Ļ�ѧ����ʽΪ___��
��3����ҵ��������ʯ����Ϊԭ������Ư�۵Ļ�ѧ����ʽΪ_____��
��4�������ڵ�![]() ��ֻ��2�����ӣ����뷽��ʽΪ___��
��ֻ��2�����ӣ����뷽��ʽΪ___��
��5��������������ͨ����ˮ�У���Ӧ�����ӷ���ʽΪ_____��
��6����Ӧ![]() �У��������뱻��ԭ����ԭ�ӵ���Ŀ��Ϊ_____��
�У��������뱻��ԭ����ԭ�ӵ���Ŀ��Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����գ�����ý��ױ�����������������������Ʈ���������������������͵�����ѧ����������ţ�ʳƷ���Ӽ���ʹ�����������ǵ�ע�⣬ؽ���淶��
��ż����һ��Ӧ�ýϹ㷺�����ϣ���ż������Է�������Ϊ88����ֻ����C��H��O����Ԫ�أ���ԭ�Ӹ�����Ϊ2��4��1����ż���к���̼��˫��������ż���йصķ�Ӧ���£�
��֪��HO��RCH��CHR����OH![]() RCHO+R��CHO
RCHO+R��CHO
��1����ż���ķ���ʽΪ__��G�Ľṹ��ʽΪ__��
��2����Ӧ�١��ڵķ�Ӧ����Ϊ����__����__��
��3��D��E��Ӧ�Ļ�ѧ����ʽΪ________________��
B��C��Ӧ�Ļ�ѧ����ʽΪ___________________��
��4��X����ż����ͬ���칹�壬�������࣬д��2��X���ܵĽṹ��ʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25 ��ʱ��CH3COOH��NH3��H2O�ĵ��볣����ȡ�
��1��25 ��ʱ��ȡ10 mL 0.1 mol��L-1������Һ�����pH��3��
�ٽ�������1����Һ��ˮϡ����1 000 mL����ҺpH��ֵ��ΧΪ___________����Һ��c(CH3COO-)/[c(CH3COOH)��c(OH-)]___________����������������С������������������ȷ��������
��25 ��ʱ��0.1 mol��L-1��ˮ��NH3��H2O��Һ����pH��___________����pH��ֽ�ⶨ�ð�ˮpH�IJ�������Ϊ_______________________________________________________��
�۰�ˮ��NH3��H2O��Һ������ƽ�ⳣ������ʽKb��_______________________________��25 ��ʱ����ˮ����ƽ�ⳣ��ԼΪ___________��
��2��25 ��ʱ������10 mL 0.1 mol��L-1��ˮ�еμ���ͬŨ�ȵ�CH3COOH��Һ���ڵμӹ�����c(NH4+)/c(NH3.H2O)___________������ţ���
a��ʼ�ռ�С b��ʼ������ c���ȼ�С������ d����������С
��3��ij�¶��£���V1mL 0.1 mol��L-1NaOH��Һ����μ����Ũ�ȵĴ�����Һ����Һ��pOH��pH�ı仯��ϵ��ͼ����֪��pOH��- lgc(OH-)��

ͼ��M��Q��N������ʾ��Һ�����Եĵ���___________������ĸ����ͬ����
ͼ��M��Q��N������ʾ��Һ��ˮ�ĵ���̶����ĵ������___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com