
����Ŀ����͵��ĵ��ʼ�һЩ�������ڹ�ũҵ��������������ҪӦ�á��ش���������:
��1��Nԭ�Ӻ�����___ �ֲ�ͬ�˶�״̬�ĵ��ӡ���̬Nԭ���У�������ߵĵ�����ռ�ݵ�ԭ�ӹ������״Ϊ____________________________��
��2�����ⶨ���֣�N2O5������NO2+��NO3-����������ɣ��ù�����Nԭ���ӻ�����Ϊ_________����NO2+��Ϊ�ȵ����������_______(д��һ��)��
��3����δ��ȶ���NH4F��NH4I�У����ֽ����____��ԭ����__________________��
��4�� �ڶ������У���һ�����ܽ���BԪ�غ�NԪ�ؼ��Ԫ��Ϊ_____(����Ԫ�ط�����)��
��5���������ж��ֱ��壬��������ṹ��Ԫ��������ԭ����ɵ�����ʮ����( ��ͼI)��ÿ������Ϊһ����ԭ��,ÿ�������ξ�Ϊ�ȱ������Ρ���ÿһ���˻����ṹ��Ԫ��_______����ԭ�ӹ���;���ýṹ��Ԫ����2 ��ԭ��Ϊ10B(����Ϊ11B)����ô�ýṹ��Ԫ��_____�ֲ�ͬ���͡�

��6����͵����ɵ�һ�ֵ�������Ľṹ��ʯī����ṹ�����ƣ�B��Nԭ�����������(��ͼII)����
�����ṹ��ͼIII��ʾ�������B-N�˼��Ϊapm������Ϊbpm����õ���������ܶ�Ϊ______g/cm3(�ú�a��b��NA �Ĵ���ʽ��ʾ)��
���𰸡� ��(����7��) ������ sp��sp2 SCN-��CO2��CS2��N3-���е���һ�� NH4F Fԭ�Ӱ뾶��Iԭ��С��H��F����H��I��ǿ(H��F�����γ�)��F-����ȡNH4+�е�H+ Be��C��O 12 3 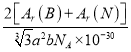 ��
��![]() ��
��![]()
����������1��ԭ�Ӻ���û�������˶�״̬��ȫ��ͬ�ĵ��ӣ��м������Ӿ��м����˶�״̬��Nԭ�Ӻ�����7�����ӣ�������7�ֲ�ͬ�˶�״̬�ĵ�������̬Nԭ�ӵĵ����Ų�ʽΪ1s22s22p3�������ɵ͵��ߣ����ﵽ���Ų�����������ߵĵ�����ռ�ݵ�ԭ�ӹ��Ϊ2p������������Σ���2��NO2+��N�ļ۵�����Ϊ![]() ���ӻ��������Ϊsp��NO3-��N�ļ۵�����Ϊ
���ӻ��������Ϊsp��NO3-��N�ļ۵�����Ϊ![]() ���ӻ�����Ϊsp2��������ͬԭ��������ͬ�۵�����������Ϊ�ȵ����壬��NO2+��Ϊ�ȵ����������SCN-��CO2��CS2��N3-�ȣ���3����δ��ȶ���NH4F��NH4I�У����ֽ����NH4F��ԭ����Fԭ�Ӱ뾶��Iԭ��С��H��F����H��I��ǿ(H��F�����γ�)��F-����ȡNH4+�е�H+����4��ͬһ����Ԫ���У�Ԫ�صĵ�һ����������ԭ����������������������ƣ�����IIA�塢��V��Ԫ��ԭ���������Ӵ��ڸù����ȫ��������������ȶ�״̬���������һ�����ܴ���������Ԫ�أ��ʵ�һ�����ܽ���B��N֮��ĵڶ�����Ԫ����Be��C��O����Ԫ�أ���5����������
���ӻ�����Ϊsp2��������ͬԭ��������ͬ�۵�����������Ϊ�ȵ����壬��NO2+��Ϊ�ȵ����������SCN-��CO2��CS2��N3-�ȣ���3����δ��ȶ���NH4F��NH4I�У����ֽ����NH4F��ԭ����Fԭ�Ӱ뾶��Iԭ��С��H��F����H��I��ǿ(H��F�����γ�)��F-����ȡNH4+�е�H+����4��ͬһ����Ԫ���У�Ԫ�صĵ�һ����������ԭ����������������������ƣ�����IIA�塢��V��Ԫ��ԭ���������Ӵ��ڸù����ȫ��������������ȶ�״̬���������һ�����ܴ���������Ԫ�أ��ʵ�һ�����ܽ���B��N֮��ĵڶ�����Ԫ����Be��C��O����Ԫ�أ���5���������� ![]() ��12����������20���棬ÿ�����Ϊ�������Σ����������㣬��ÿ�����㶼ͬʱ����5���棬������12��ԭ�ӣ���ѡ��1���������������Ķ�����Ϊ5����Ȼ�����5����1��������ȡ������3�֣����ýṹ��Ԫ��3�ֲ�ͬ���ͣ���6������ͼIII��֪һ�������к���Nԭ����Ϊ
��12����������20���棬ÿ�����Ϊ�������Σ����������㣬��ÿ�����㶼ͬʱ����5���棬������12��ԭ�ӣ���ѡ��1���������������Ķ�����Ϊ5����Ȼ�����5����1��������ȡ������3�֣����ýṹ��Ԫ��3�ֲ�ͬ���ͣ���6������ͼIII��֪һ�������к���Nԭ����Ϊ![]() ��Bԭ����Ϊ
��Bԭ����Ϊ![]() ����һ���������г���ȵ�������ÿ���ĵ�Ϊapm=a
����һ���������г���ȵ�������ÿ���ĵ�Ϊapm=a![]() cm����Ϊ
cm����Ϊ pm�����Ϊ
pm�����Ϊ![]() �����������Ϊ
�����������Ϊ![]() �����ܶ�Ϊ
�����ܶ�Ϊ =
=![]() =
=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��CO2�ǻ�ʯȼ��ȼ�յ���Ҫ���
(1)����0.02mol CO2��0.01 mol CO�Ļ������ͨ��������Na2O2������ܱ������У�ͬʱ���ϵ��õ��ȼ����ַ�Ӧ������������_____g��
(2)��֪��2CO(g)+O2(g)==2CO2(g) ��H=-566.0kJ/mol������Eo-o=499.0kJ/mol����Ӧ:CO(g)+O2(g)![]() CO2(g)+O(g)�ġ�H=_________kJ/mol��
CO2(g)+O(g)�ġ�H=_________kJ/mol��
(3)��ij�ܱ������з�����Ӧ:2CO2(g)![]() 2CO(g)+O2(g)��1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ��ʾ��
2CO(g)+O2(g)��1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ��ʾ��

�ٺ��º���������,�ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����___(����ĸ)��
A.CO������������ֲ��� B.�����ڻ��������ܶȱ��ֲ���
C.�����ڻ�������ƽ��Ħ���������ֲ���
D.��λʱ���ڣ�����CO��Ũ�ȵ�������CO2��Ũ��
�ڷ�����ͼ����1500��ʱ��Ӧ�ﵽƽ��״̬�����������Ϊ1L�����ʱ��Ӧ��ƽ�ⳣ��K=___(����������1λС��)��
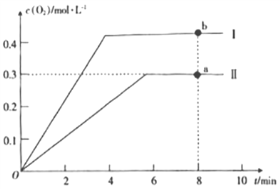
����2L�ĺ����ܱ������г���2molCO2(g)��������Ӧ: 2CO2(g)![]() 2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II��ʾ��ͼ������I��ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������____��a��b������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)____(�>����<����=��)vb(CO)��
2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II��ʾ��ͼ������I��ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������____��a��b������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)____(�>����<����=��)vb(CO)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯȼ�Ͽ��ɡ��ӹ����̲�����H2S��������ͨ�����ַ�������������������ȡ������ͬʱ�������ʣ��������ֻ������ش��������⣺
(1)��֪��2H2(g)+O2(g)=2H2O(g) ��H1
S(s)+ O2(g)=SO2(g) ��H2
2S(s)![]() S2(g) ��H3
S2(g) ��H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) ��H4
��Ӧ2H2S(g)![]() 2H2(g)+ S2(g)�ġ�H=_____
2H2(g)+ S2(g)�ġ�H=_____
(2)��ҵ�ϲ��ݸ����ȷֽ�HzS�ķ�����ȡH2����Ĥ��Ӧ���з����H2��
�ں����ܱ������У���H2S����ʼŨ�Ⱦ�Ϊ0.009 mol/L���Ʋ�ͬ�¶Ƚ���H2S�ֽ⣺![]() ��ʵ������в��H2S��ת������ͼ��ʾ������a��ʾH2S��ƽ��ת�������¶ȵĹ�ϵ������b��ʾ��ͬ�¶�F��Ӧ������ͬʱ��ʱH2S��ת���ʡ�
��ʵ������в��H2S��ת������ͼ��ʾ������a��ʾH2S��ƽ��ת�������¶ȵĹ�ϵ������b��ʾ��ͬ�¶�F��Ӧ������ͬʱ��ʱH2S��ת���ʡ�

����935��ʱ���÷�Ӧ����t s H2S��ת���ʴﵽP����ֵ������ts����H2Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2)=________��
���¶����ߣ�ƽ����____�����ƶ��������Ӧ�����淴Ӧ������ƽ�ⳣ��____���������С�����䡱����985��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ________��
������H2S�ֽ��¶ȵ����ߣ�����b��������a��������ԭ����___________��
(3)��ⷨ��������������FeCl3��Һ���պ�H2S�Ĺ�ҵ������������Һ�ö��Ե缫��⣬������������Һѭ�����á�

�ٽ�����ص���Һ�У�������____��
�������ĵ缫��ӦʽΪ________________��
�۵���ܷ�Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��һ�������£�����Һ�塢�������������屽���������ķ�Ӧ������ȡ����Ӧ
B. C6H14��4��ͬ���칹�壬���ǵ��۵㡢�е������ͬ
C. ��֬������Ӧ�õ���֬�����������
D. �ۺ���(![]() )���ɵ���CH3CH=CH2��CH2=CH2 �Ӿ��Ƶ�
)���ɵ���CH3CH=CH2��CH2=CH2 �Ӿ��Ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����cmol/L��ˮ����10mL.0.1mol/L�����У���ҺpH���¶�����백ˮ����仯������ͼ��ʾ�������й�˵����ȷ����
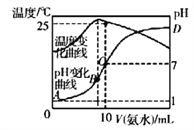
A. c=0.1
B. 25��ʱ��NH4Cl��ˮ�ⳣ��(KA)=(10c-1)��10-7
C. ˮ�ĵ���̶�:B>C>A>D
D. B��:c(NH3��H2O)+c(H+)=c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ������˵������ȷ���ǣ� ��
A.���³�ѹ�£�32gO2��32gO3������ԭ��������2NA
B.ͬ�¡�ͬѹ�£���ͬ����ķ��������������ԭ�������
C.18g D2O���еĵ�����Ϊ9NA
D.2.4g����þ���þ����ʱʧȥ�ĵ�����ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H �Ǻϳɿ���ҩ��������ƵĹؼ��м��壬����һ�ֺϳ�·������:
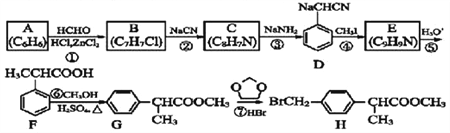
�ش���������:
(1)�����Ǽ��A������ͼ�У�����ʺɱȵ���ֵ��________��G�й�����������__________��
(2)B�Ľṹ��ʽΪ_________________________��
(3)��Ӧ�ڵķ�Ӧ����Ϊ_________________________����Ӧ�ܵĻ�ѧ����ʽΪ____________��
(4)д����������������F��ͬ���칹��Ľṹ��ʽ:________________________��
I.����FeCl3��Һ������ɫ��Ӧ
II.�ܷ���������Ӧ
III.�˴Ź���������4����ҷ����֮��Ϊ6:2:1:1
(5)����H �ĺϳ�·�ߣ����һ����![]() �ĺϳ�·��______��
�ĺϳ�·��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ͼʾ�ĸ�װ�õ���������ȷ����



A. װ�ü��ǿ����������϶�ͭ��װ��
B. װ������Ϊ��⾫��ͭװ�ã���X�缫Ϊ��ͭ
C. װ�ñ���a�˲�����������ʹʪ��ĵ��۵⻯����ֽ����
D. װ�ö������ڲⶨ��ѧ��Ӧ�ķ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ͽṹ��ͼ������һ���������ܷ����ķ�Ӧ�У��������� �ټӳɷ�Ӧ
��ˮ�ⷴӦ
����ȥ��Ӧ
��ȡ����Ӧ
����NaHCO3��Ӧ�ų�CO2
�Ӿ۷�Ӧ��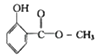
A.�٢ڢ�
B.�٢ڢ�
C.�ܢݢ�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com