
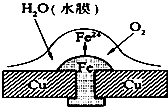
| A、此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B、此过程中铜并不被腐蚀 |
| C、此过程中电子从Fe移向Cu |
| D、正极电极反应式为:2H++2e-=H2↑ |


科目:高中化学 来源: 题型:
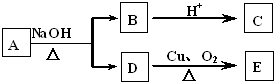
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
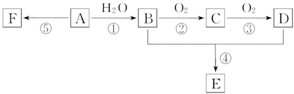 A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;它有如图所示的转化关系.E是有香味的有机物,F是高分子化合物.
A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;它有如图所示的转化关系.E是有香味的有机物,F是高分子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向溴乙烷中加入NaOH溶液,加热,充分反应后,加入AgNO3溶液 | 观察生成沉淀的颜色,以确定含有溴元素 |
| B | 向乙醛溶液中加入新制的银氨溶液,用酒精灯直接加热 | 确定乙醛中是否含有醛基 |
| C | 向苯和酒精的混合液中加入金属钠 | 确定苯中是否有酒精 |
| D | 纯净的乙炔气通入溴水溶液中,溴水褪色,且溶液pH前后变化不大 | 说明乙炔与Br2发生了加成反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | ①室温下,分别取等体积0.1mol/L FeCl3溶液与 |
| ② | |
| ③ | |
| 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤②⑥④③ |
| B、①⑤②④⑥③ |
| C、①②④⑥⑤③ |
| D、①②⑤⑥④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁投入稀盐酸中 |
| B、铜片与银片用导线连接后,同时插入FeCl3溶液中 |
| C、纯锌投入硫酸铜溶液中 |
| D、含铜的铝片投入浓硫酸中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com