
| 实验步骤 | ①室温下,分别取等体积0.1mol/L FeCl3溶液与 |
| ② | |
| ③ | |
| 预期现象和结论 |


 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
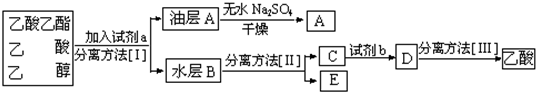
查看答案和解析>>
科目:高中化学 来源: 题型:
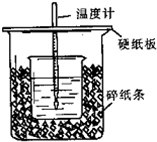
查看答案和解析>>
科目:高中化学 来源: 题型:
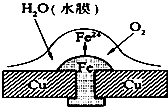
| A、此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B、此过程中铜并不被腐蚀 |
| C、此过程中电子从Fe移向Cu |
| D、正极电极反应式为:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
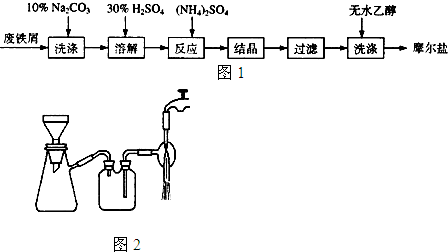
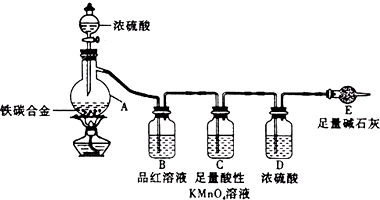 某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质
某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN溶液一定不变红色 |
| B、溶液中一定含Fe2+ |
| C、溶液中一定不含Cu2+ |
| D、剩余固体中一定含Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com