
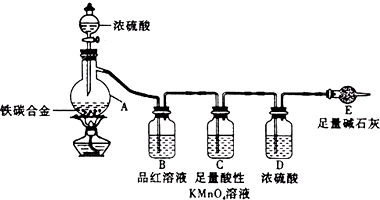
 某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质
某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题.Ⅰ探究浓硫酸的某些性质
| ||
| ||
| ||
| ||
| bg |
| 44g/mol |
| 3b |
| 11 |
| 3b |
| 11 |
m-
| ||
| a |
| 11m-3b |
| 11m |
| 11m-3b |
| 11m |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏和煤的干馏都是物理变化 |
| B、棉与蚕丝完全燃烧都只生成CO2和H2O |
| C、淀粉和纤维素水解的最终产物都是葡萄糖 |
| D、鸡蛋清溶液中加入CuSO4溶液会发生盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 |
| B、用酒精灯给试管加热时,要将被加热的试管放在酒精灯火焰的外焰上 |
| C、为加速固体物质的溶解只能采用加热的方法 |
| D、为增大气体物质的溶解度,常采取搅拌、加热等措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | ①室温下,分别取等体积0.1mol/L FeCl3溶液与 |
| ② | |
| ③ | |
| 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、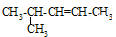 2-甲基-3-戊烯 |
B、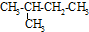 异丁烷 |
| C、CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
| D、CH3CH(NO2)CH2COOH 3-硝基丁酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2和Na2CO3 |
| B、稀H2SO4和Na2CO3 |
| C、KOH和Al2(SO4)3 |
| D、HCl NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓溴水、氯化铁溶液 |
| B、浓溴水、酸性高锰酸钾溶液 |
| C、浓溴水、碳酸钠溶液 |
| D、氯化铁溶液、酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com