
【题目】锑(Sb)是第VA族元素,其单质主要用于制造合金、半导体。三氧化二锑俗称锑白,是白色粉末,不溶于水,是一种两性氧化物,主要用于白色颜料、油漆和塑料、石油化工等。某工厂用羽毛矿(主要成分为Pb4FeSb6S14)制取锑白的工艺流程如图所示:

(1)Pb4FeSb6S14中的锑元素只显一种化合价,则其化合价是______。X是一种固体单质,其成分是___(填化学式)。
(2)氯化浸出中,除铅与X外,被氧化的元素反应后均显高价,写出相应的化学方程式:______________。操作1为加水稀释,写出生成SbOCl的离子方程式:___________。
(3)试剂1通常选用氨水而不是NaOH溶液,最可能的原因是_______。操作2的内容是_________、干燥。
(4)在强碱性条件下电解Na3SbS3溶液(原理如图)可得到单质锑。

写出阴极的电极反应式:_______,B电极应接电源的______极,当有2 mol Sb生成时,通过阳离子交换膜的离子数为_________(设NA为阿伏加德罗常数的值)。
【答案】+3 S 2Pb4FeSb6S14+41Cl2=8PbCl2+2FeCl3+12SbCl5+28S Sb3++Cl-+H2O=SbOCl↓+2H+ Sb2O3可溶解在过量的NaOH溶液中,但不会溶解在过量的氨水中 过滤、洗涤 SbS33-+3e-=Sb+3S2- 正 6NA
【解析】
(1)锑是第VA 族元素,主要化合价为+5、+3。Pb4FeSb6S14中硫元素显 -2价,由元素化合价与原子结构关系及化合物中元素化合价代数和等于0可推知锑的化合价为+3价。X是一种固体单质,结合常见元素单质的状态可推知X只能是硫;
(2)由被氧化的元素反应后均显高价知,反应后有FeCl3、SbCl5生成,再结合流程图知还有PbCl2、S生成,由此可写出相应的化学方程式。稀释可促进水解,因SbOC1是通过水解反应生成的,故反应物有Cl-、H2O、Sb3+,据此可得水解方程式;
(3)根据Sb2O3是两性氧化物,能够与强酸、强碱发生反应,不能与弱酸、弱碱反应分析;根据物质的溶解性及操作目的分析解答;
(4)阴极上发生得电子的还原反应,电解Na3SbS3得到单质Sb,故阴极上为SbS33-得到电子产生Sb 及S2-。结合装置电荷守恒分析通过交换膜的阳离子数目。
(1)锑是第VA 族元素,主要化合价为+5、+3。在Pb4FeSb6S14中硫元素显 -2价,Pb为+2价,Fe为+2价,假设Sb元素化合价为+x,根据化合物中元素化合价代数和等于0可得4×2+2+6x=2×14,解得x=+3价。羽毛矿主要成分为Pb4FeSb6S14,向其中加入水,然后通入Cl2进行氧化反应,金属变为金属氯化物,S被氧化为S单质,S单质在常温下为固体,所以X只能是硫;
(2)根据题意可知:羽毛矿Pb4FeSb6S14与氯气反应时,S被氧化变为S单质,Pb变为PbCl2,其余元素被氧化为高价态,则根据原子守恒、电子守恒,可得该反应的化学方程式:2Pb4FeSb6S14+41Cl2=8PbCl2+2FeCl3+12SbCl5+28S;操作1为加水稀释,生成难溶性的SbOCl,根据盐的水解规律,结合电荷守恒、原子守恒可得Sb3++Cl-+H2O=SbOCl↓+2H+;
(3)由题意可知Sb2O3是两性氧化物,能够与强碱NaOH发生反应,所以Sb2O3可溶解在过量的NaOH溶液中,但不会溶解在过量的氨水中,因此试剂1通常选用氨水而不是NaOH溶液;分离难溶性固体与可溶性液体混合物使用过滤方法,然后经沉淀经洗涤、干燥得到锑白;
(4)与电源负极连接的电极为阴极,得到电子发生还原反应,由题意可知:电解Na3SbS3溶液得到Sb单质,则在阴极上发生反应:SbS33-+3e-=Sb+3S2-,故A为电源的负极,B为电源的正极;根据电解时阴极电极式可知:每产生1 mol Sb,转移3 mol电子,则生成2 mol Sb时,转移6 mol电子,同时得到6 mol S2-,根据溶液呈电中性可知要有6 mol Na+通过阳离子交换膜,通过了Na+数目为6NA。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】蛋白质、油脂、糖类都是人体必需的营养物质。
(1)蛋白质完全水解后生成_____ (写名称),通常情况下,蛋白质遇饱和硫酸钠溶液会发生_____(填“盐析”或“变性”).
(2)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和_______(填名称)。
(3)淀粉遇I2显__色,淀粉在淀粉酶的作用下最终水解为葡萄糖,其水解的化学反应方程式为__,可检验淀粉发生水解的试剂是_____ ( 填字母)。
a.碘水 b.碘化钾溶液 c.新制的银氨溶液
(4)葡萄糖在人体中发生缓慢氧化,放出热量。已知0.1 mol葡萄糖完全氧化能释放出280.3kJ的热量,请写出葡萄糖供能的热化学方程式:___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
①CH4②CH3CH2OH③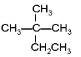 ④癸烷⑤CH2=CH2⑥
④癸烷⑤CH2=CH2⑥![]() ⑦
⑦![]() ⑧
⑧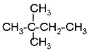 ⑨丙烷
⑨丙烷
请根据上述给出的物质按要求回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为_____________;它与⑧互为_____________关系;
(2)与③互为同分异构体的是_____________(填序号);
(3)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是_____________(填序号);
(4)用“>”表示①③④⑨熔沸点高低顺序:_____________(填序号);
(5)具有特殊气味,常作萃取剂的有机物在催化剂的条件下与液溴发生反应的化学方程式_____________;
(6)有机物②在加热条件下和CuO反应的化学方程式_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个NH4+含有质子的物质的量是____ ,含有电子的物质的量是_____;
(2)200mL 2mol/L的Al2(SO4)3溶液中SO42﹣的物质的量浓度为_____ ;
(3)标准状况下,36g H2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为______;
(4)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为____;
(5)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查询资料后得到如下信息:柠檬烯(![]() )的沸点为177℃,熔点为-74.3℃,密度为0.84 g/mL,具有良好的镇咳、祛痰、抑菌作用,广泛存在于天然的植物精油中。
)的沸点为177℃,熔点为-74.3℃,密度为0.84 g/mL,具有良好的镇咳、祛痰、抑菌作用,广泛存在于天然的植物精油中。
(一)粗精油的提取。该同学利用如图所示装置(加热、夹持及冷凝管内管均省略)从植物组织中获取粗精油,实验步骤如下:
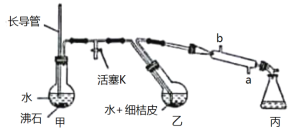
i.将几片桔子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水;
ii.打开活塞K,加热甲至K处的支管口有大量水蒸气冒出时旋紧,再打开冷凝水,水蒸气蒸馏即开始进行。可观察到在馏出液的水面上有一层很薄的油层。
(1)甲中长导管的作用是___________。蒸馏结束时,应先将_____________,再停止加热。
(2)冷凝管的内管应是_________(填“蛇”“球”或“直”)形的。若冷却水从b口进入,则对提取到精油量的影响情况是____________。
(二)柠檬烯的提取。
i.将馏出液加入到仪器A中,然后加入适量的CH2Cl2(沸点为40℃)萃取3次,最后将萃取液置于干燥的锥形瓶中,并加入适量的试剂A干燥半个小时。
ii.将干燥好的溶液加入蒸馏烧瓶中,通过一系列操作,最后烧瓶中剩下的橙黄色液体就是柠檬烯。
(3)仪器A是_________,试剂A可以是_______(写出两种)。若将一定量的橙黄色液体滴入溴的CCl4溶液中,溶液褪色,由此现象可得出的恰当结论是____________。
(4)若桔皮总质量为a g,最后得到V mL柠檬烯,实验过程中柠檬烯的总损失率为b% ,则枯皮中柠檬烯的质量分数为_____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以北京大学马丁教授为代表的多个团队,研发出了高效的铁基(如FeC、Fe2C、Fe5C2、Fe3C)费托合成催化剂,以H2和CO为原料可高产率合成烯烃、烷烃,如3CO(g)+ 6H2(g)![]() CH3CH=CH2(g)+3H2O(g)、nCO+(2n+1)H2
CH3CH=CH2(g)+3H2O(g)、nCO+(2n+1)H2![]() CnH2n+2+nH2O,为煤的气化、液化使用开拓了新途径。
CnH2n+2+nH2O,为煤的气化、液化使用开拓了新途径。
(1)Fe3+中能量最高的能级上的电子云有_____种伸展方向,位于不同方向中运动的电子的能量大小关系是_________。当Fe原子电子排布由[Ar]3d64s2→[Ar]3d64s14p1时,体系的能量_______(填“增大”或“减小”)。
(2)Fe、C、O三种元素的第一电离能由大到小的顺序为_____________;CH3CH=CH2分子中碳原子的杂化轨道类型为____,题干所述反应中CO分子中断裂的化学键类型为______(填字母)。
A. 2个σ键、1个π键 B. 1个σ键、2个π键 C. 非极性键
(3)新戊烷[(CH3)4C]分子中5个碳原子形成的空间构型是____________,该分子是________(填“极性”或“非极性”)分子。随着烃分子中碳原子数目的增加,同系物的沸点升高.其原因是__________。
(4)碳铁之间可形成多种化合物,其中一种化合物的晶体结构(面心立方结构)如图所示:

则编号为①的原子的坐标为_______________;该化合物的化学式为_______________,设该晶体的晶胞多数为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为_______________ g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜是重要的化工原料,广泛用做有机合成催化剂。实验室可用如图所示装置,用还原铜粉和氯气来制备氯化铜,已知:氯化铜容易潮解。

(1)配平A装置中发生化学反应的方程式:____KMnO4+_____HCl(浓) =_____KCl+_____MnCl2 + ____Cl2↑+ _____H2O,装浓盐酸的仪器名称是____________。
(2)B装置的作用是____________,C装置中的试剂是____________。E装置的作用是____________。
(3)F中发生的化学反应的离子方程式为____________。
(4)当Cl2排尽空气后,加热D,装置D中的现象是____________。
(5)某同学用不纯的铜粉(含少量铁粉)进行实验。铜粉和铁粉完全反应后,取少量产物于一洁净的试管中,加水溶解,再加入____________(填试剂),出现_____________(填现象),则证明产物中含有 FeCl3。
(6)用15.8 g KMnO4固体与足量的浓盐酸反应,被氧化的HCl是____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象、得出的结论均正确的是
选项 | 实验操作和现象 | 结论 |
A | 某溶液 | 原溶液中一定含有CO32- |
B | 用湿润的pH试纸测某碱液的pH,测定值偏小 | 湿润的pH试纸测量任何溶液都会产误差 |
C | 将浓硫酸倒入蔗糖中搅拌蔗糖迅速变黑并伴有刺激性气味 | 浓硫酸具有脱水性和强氧化性 |
D | 将乙烯和苯分别加入到溴水中,都能使溴水层褪色 | 乙烯和苯分子中都含有碳碳双键 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com