
下列反应适用于实验室制备氧气的是
①高锰酸钾热分解 2KMnO4 K2MnO4+MnO2+ O2↑
K2MnO4+MnO2+ O2↑
②硝酸铵热分解 2NH4NO3 4H2O+2N2↑+ O2↑
4H2O+2N2↑+ O2↑
③过氧化氢催化分解 2H2O2 2H2O +O2↑
2H2O +O2↑
④二氧化氮热分解 2NO2 2NO+ O2↑
2NO+ O2↑
| A.只有① | B.①和② | C.①和③ | D.①③④ |
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:单选题
利用以下装置能实现预想的是
| 选项 | 甲 | 乙 | 丙 | 实验目的 |
| A | 浓氨水 | NaOH | 饱和食盐水 | 制取并收集氨气 |
| B | 浓盐酸 | MnO2 | 饱和食盐水 | 制取并收集氯气 |
| C | 稀硝酸 | Cu | 水 | 制取并收集一氧化氮 |
| D | 稀硝酸 | Zn | 水 | 制取并收集氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图所示是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是 
| A.铜屑和浓硝酸 | B.二氧化锰和浓盐酸 |
| C.氯酸钾和MnO2 | D.碳酸钙和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图所示装置中,若关闭活塞,则品红溶液无变化,石蕊溶液变红,石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )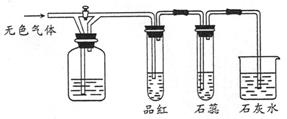
| A.SO2和H2SO4(浓) |
| B.SO2和饱和NaHCO3 |
| C.Cl2和NaHSO3 |
| D.NO2和KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置)。仅用此装置和表中提供的部分物质完成相关实验。
| 序号 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| 甲 | 浓硫酸 | Na2SO3 | ① | ② |
| 乙 | 浓硝酸 | Cu | ③ | NaOH |
| 丙 | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
 MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式: ____ Mn2+ + ____ Cl2↑+ ____ _________
____ Mn2+ + ____ Cl2↑+ ____ _________查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题。
(1)选用A装置可制取的气体有 ;选用B装置可制取的气体有 ;通常选用C装置制取的气体有 。若用亚硫酸钠和浓硫酸来制取二氧化硫气体应选用装置 (填装置的编号字母)。
(2)写出利用上述有关药品制取氯气的化学方程式: 。
(3)若要制得干燥的氨气,可选用下列干燥剂中的 (填序号)。
A.生石灰 B.浓硫酸 C.五氧化二磷
(4)标号①的仪器除可用于在气体发生装置中添加试剂外,在实验中常用于 (填实验操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景。下图是利用海水制盐的副产品制备纳米氧化镁的流程图。
(1)操作I包括蒸发结晶、____________。
(2)操作I后得到的母液中镁离子浓度为1.8×10-3 mol·L-1,要使镁离子产生沉淀,溶液的pH最低应为_____________。(已知:Ksp[Mg(OH)2]= 1.8×10-11)
(3)反应I中CO(NH2)2与H2O反应生成CO2和NH3·H2O,还发生另一主要化学反应的离子方程式为______________________________。
(4)某科研小组研究反应I在378K~398K时的反应时问、反应物的物质的量配比等因素对制备纳米氧化镁产率的影响。请完成以下实验设计表:
| 实验 编号 | T/K | 反应 时间/h | 反应物的物质的量配比 n[CO(NH2)2]∶n[MgCl2?6H2O] | 实验目的 |
| ① | 378 | 3 | 3∶1 | (I)实验①和③探究探究反应物的物质的量配比对产率的影响; (II)实验②和④探究 ; (III)实验②和 探究反应时间对产 率的影响。 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | | |
| ④ | 398 | 4 | 4∶1 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
三氯化六氨合钴(Ⅲ)是一种重要的化工产品, 实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2CoCl2·6H2O + 10NH3 + 2NH4Cl + H2O2 活性炭2[Co(NH3)6]Cl3 +14H2O
已知:① 钴(Ⅱ)与氯化铵和氨水作用,经氧化后一般可生成三种产物:紫红色的二氯化一氯五氨合钴[Co(NH3)5 Cl]Cl2晶体、砖红色的三氯化五氨一水合钴[Co(NH3)5 H2O]Cl3晶体、橙黄色的三氯化六氨合钴[Co(NH3)6]Cl3晶体,控制不同的条件可得不同的产物(如温度不同产物也不同)。293K时,[Co(NH3)6]Cl3在水中的溶解度为0.26mol/L
②CoCl2、[Co(NH3)6]Cl3、[Co(NH3)5 Cl]Cl2在水中能完全电离
③制备三氯化六氨合钴(Ⅲ)粗产品的流程如下:
④三氯化六氨合钴(Ⅲ)粗产品的提纯流程如下:
⑤制备过程中可能用到的部分装置如下:
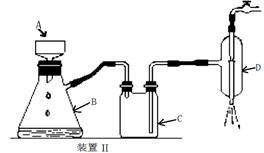

请回答下列问题:
(1)操作B的名称是 ,操作A后所弃去的沉淀中一定有 。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该反应的离子方程式为 。原料NH4Cl的主要作用有:① ;②提供NH3。
(3)冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的:① ;②使反应温和进行。
(4)操作A的名称为 ,进行该操作的装置是 (填序号)。
A.装置Ⅰ B.装置Ⅱ C.装置Ⅲ
若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是 。
装置Ⅱ中仪器A、B、C、D的名称分别是 、 、 、 。
(5)步骤C进行洗涤时要用到两种试剂,应该先用_____(填序号,下同)洗涤,后用 洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
(6)你认为本实验提高产率的关键步骤有哪些? 。
(7)与[Co(NH3)6]Cl3类似的产品还有[Co(NH3)5Cl]Cl2,请简述验证某晶体是[Co(NH3)6]Cl3还是
[Co(NH3)5Cl]Cl2的实验方案: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com