
纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景。下图是利用海水制盐的副产品制备纳米氧化镁的流程图。
(1)操作I包括蒸发结晶、____________。
(2)操作I后得到的母液中镁离子浓度为1.8×10-3 mol·L-1,要使镁离子产生沉淀,溶液的pH最低应为_____________。(已知:Ksp[Mg(OH)2]= 1.8×10-11)
(3)反应I中CO(NH2)2与H2O反应生成CO2和NH3·H2O,还发生另一主要化学反应的离子方程式为______________________________。
(4)某科研小组研究反应I在378K~398K时的反应时问、反应物的物质的量配比等因素对制备纳米氧化镁产率的影响。请完成以下实验设计表:
| 实验 编号 | T/K | 反应 时间/h | 反应物的物质的量配比 n[CO(NH2)2]∶n[MgCl2?6H2O] | 实验目的 |
| ① | 378 | 3 | 3∶1 | (I)实验①和③探究探究反应物的物质的量配比对产率的影响; (II)实验②和④探究 ; (III)实验②和 探究反应时间对产 率的影响。 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | | |
| ④ | 398 | 4 | 4∶1 |

(16分)
(1)过滤(2分)(写趁热过滤1分)
(2)10(3分)
(3)Mg2++2NH3·H2O=Mg(OH)2↓ + 2NH4+ (3分)
(4)③4∶1 (2分) (II)温度对产率的影响(2分) (III)③(1分)
(5)其他条件相同时,在376K~411K,纳米MgO的产率随温度升高而升高,之后纳米MgO的产率随温度升高而降低(或其他条件相同时,纳米MgO的产率随温度的升高先升高后降低,或396K左右纳米MgO产率最高)(3分)
解析试题分析:(1)较高温度时NaCl等溶解度小于MgCl2等物质,联系海水晒盐推断,操作I包括蒸发结晶、过滤,滤渣主要成分是粗盐,滤液主要成分是MgCl2等;(2)由于Mg(OH)2(s) Mg2++2OH-,Ksp[Mg(OH)2]=c(Mg2+)?c2(OH-),则c2(OH-)=
Mg2++2OH-,Ksp[Mg(OH)2]=c(Mg2+)?c2(OH-),则c2(OH-)=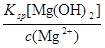 ,c(OH-)=
,c(OH-)= =
=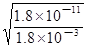 mol/L=1.0×10-4 mol/L;由于Kw= c(H+)?c(OH-),则c(H+)=
mol/L=1.0×10-4 mol/L;由于Kw= c(H+)?c(OH-),则c(H+)=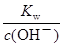 =
=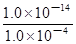 mol/L=1.0×10-10 mol/L;由于pH="—lg" c(H+)=10,则使镁离子开始沉淀的pH最小为10;(3)可溶性镁盐溶液与氨水反应可以制取氢氧化镁,该反应为Mg2++2NH3·H2O=Mg(OH)2↓ + 2NH4+ ;(4)(I)实验①和③探究探究反应物的物质的量配比对产率的影响,则实验①和③中其它条件都相同,只有反应物的物质的量配比不同,①中反应物的物质的量配比为3∶1,③中反应物的物质的量配比为4∶1;(II)实验②和④的其它条件相同,只有反应温度分别是378K、398K,则这组实验的目的是探究温度对产率的影响;(III)实验①和②的其它条件都相同,只有反应时间分别为3h、4h,因此该组实验的密度是探究反应时间对产率的影响;(5)读图,横坐标表示反应温度,纵坐标表示纳米MgO产率,在其它条件相同或不变时,在378K~411K之间,纳米MgO的产率随温度升高而升高,之后纳米MgO的产率随温度升高而降低(或其他条件相同时,纳米MgO的产率随温度的升高先升高后降低,或396K左右纳米MgO产率最高)。
mol/L=1.0×10-10 mol/L;由于pH="—lg" c(H+)=10,则使镁离子开始沉淀的pH最小为10;(3)可溶性镁盐溶液与氨水反应可以制取氢氧化镁,该反应为Mg2++2NH3·H2O=Mg(OH)2↓ + 2NH4+ ;(4)(I)实验①和③探究探究反应物的物质的量配比对产率的影响,则实验①和③中其它条件都相同,只有反应物的物质的量配比不同,①中反应物的物质的量配比为3∶1,③中反应物的物质的量配比为4∶1;(II)实验②和④的其它条件相同,只有反应温度分别是378K、398K,则这组实验的目的是探究温度对产率的影响;(III)实验①和②的其它条件都相同,只有反应时间分别为3h、4h,因此该组实验的密度是探究反应时间对产率的影响;(5)读图,横坐标表示反应温度,纵坐标表示纳米MgO产率,在其它条件相同或不变时,在378K~411K之间,纳米MgO的产率随温度升高而升高,之后纳米MgO的产率随温度升高而降低(或其他条件相同时,纳米MgO的产率随温度的升高先升高后降低,或396K左右纳米MgO产率最高)。
考点:考查有关物质制备的化学工艺流程,涉及混合物分离提纯的操作方法、溶度积、水的离子积、溶液的pH、离子方程式、设计探究实验方案、根据图像规律温度对产率的影响规律等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
根据右图装置和表中提供的物质完成实验室制取、收集表中气体并进行尾气处理 (省略夹持、加热及净化装置),最合理的选项是
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 稀硫酸 | 石灰石 | CO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应适用于实验室制备氧气的是
①高锰酸钾热分解 2KMnO4 K2MnO4+MnO2+ O2↑
K2MnO4+MnO2+ O2↑
②硝酸铵热分解 2NH4NO3 4H2O+2N2↑+ O2↑
4H2O+2N2↑+ O2↑
③过氧化氢催化分解 2H2O2 2H2O +O2↑
2H2O +O2↑
④二氧化氮热分解 2NO2 2NO+ O2↑
2NO+ O2↑
| A.只有① | B.①和② | C.①和③ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如图),其实验流程如下:

(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为 。
(2)80℃时浸取液冷却至0℃过滤,滤渣的主要成分为 (写化学式)。
(3)反应器中加入氯化铵饱和溶液发生反应的离子方程式为 。
(4)已知:2NH4ClO4  N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
a.饱和食盐水 b.浓H2SO4 c.NaOH溶液 d.Mg e.Cu f.Fe
利用下图装置对高氯酸铵热分解产生的三种气体进行分步吸收或收集。

①E中收集到的气体可能是 (填化学式) 。
②装置D的作用可能是 。
③A、B、C中盛放的药品依次可以是 (选填:Ⅰ、Ⅱ、Ⅲ)。
Ⅰ. a b d Ⅱ. c b e Ⅲ. b c f
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如下图所示。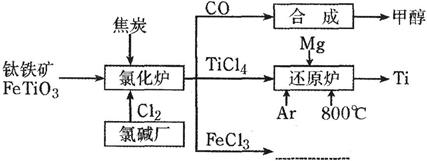
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用___________________;已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是________________________;
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) △H=-641kJ?molˉ1
② 2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) △H=-512kJ?molˉ1
则Ti(s)+2Cl2(g)= TiCl4(s) △H= ;
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_______________________;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OHˉ=2CO32ˉ+6H2O,该电池中负极上的电极反应式是:2CH3OH-12eˉ+16OHˉ=2CO32ˉ+12H2O。则正极上发生的电极反应为:___________。工作一段时间后,测得溶液的pH是____(填“减小”、“增大”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知:
| | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |


查看答案和解析>>
科目:高中化学 来源: 题型:问答题
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。
(1)某研究小组设计SnSO4制备路线如下:
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
①SnCl2酸溶后加入Sn粉的作用是 ;
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有 ;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为 。
③步骤Ⅴ涉及到的操作有:a.过滤 b.洗涤 c.蒸发浓缩 d.冷却结晶 e.低温干燥,则其正确的操作顺序为 。
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
①装置C中应加入试剂为 ;仪器E的名称为 。
②反应开始生成SnCl4时,可以先熄灭 (填字母序号)处的酒精灯,理由是 。
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等) 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小。某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
实验过程如下:在容积为100mL的三颈烧瓶中将5mL浓硫酸、14.8g正丁醇和几粒沸石混合均匀,再加热回流一段时间,收集到粗产品,精制得到正丁醚。回答下列问题:
(1)合成粗产品时,液体试剂加入顺序是 。
(2)实验中冷凝水应从 口出去(填“a”或“b”)。
(3)为保证反应温度恒定在135℃,装置C中所盛液体必须具有的物理性质为 。
(4)加热时间过长或温度过高,反应混合液会变黑,写出用NaOH溶液吸收有毒尾气的离子方程式 。
(5)得到的正丁醚粗产品依次用8 mL50%的硫酸、10 mL水萃取洗涤。该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、 。该仪器使用前需要 。
(6)将分离出的有机层用无水氯化钙干燥,过滤后再进行 (填操作名称)精制得到正丁醚。
(7)本实验最终得到6.50g正丁醚,则正丁醚的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
可用如图所示装置制取、净化、收集的气体是
| A.锌和稀硝酸反应制一氧化氮 |
| B.亚硫酸钠与浓硫酸反应制二氧化硫 |
| C.铁和稀硫酸反应制氢气 |
| D.浓氨水和生石灰反应制取氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com