
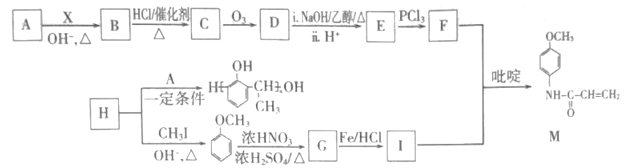
【题目】有机物M是一种重要的医药活性中间体,其合成路线如图:
已知:ⅰ.2CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO
ⅱ.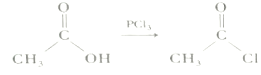
ⅲ.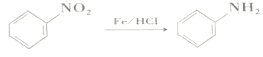 (在空气中极易被氧气氧化)
(在空气中极易被氧气氧化)
请回答以下问题:
(1)B中官能团名称为___,检验其官能团所需试剂先后顺序为___(填字母)。
a.银氨溶液 b.NaOH溶液 c.稀硫酸 d.稀盐酸 e.酸性高锰酸钾溶液
(2)F与I的反应类型是___,吡啶是一种有机碱,其作用为___。
(3)写出![]() 与A反应的化学方程式___。
与A反应的化学方程式___。
(4)N是G的同分异构体,写出满足下列条件N的两种结构简式___。
①苯环上的一氯代物有两种②含有两种官能团③能发生银镜反应
(5)写出以![]() 为原料制备
为原料制备 的合成路线(其它无机试剂任选)___。
的合成路线(其它无机试剂任选)___。
【答案】碳碳双键、醛基 ace 取代反应 防止氨基被氧化 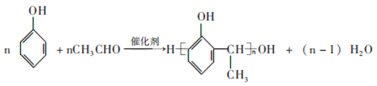
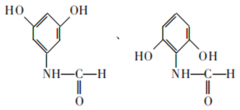

【解析】
根据题中信息可以反推出F为CH2=CHCOCl,I为![]() ,根据F反推E为CH2=CHCOOH,D为CH3CHClCOOH或ClCH2CH2COOH,C为CH3CHClCHO或ClCH2CH2CHO,B为CH2=CHCHO,H和A发生反应推出A为CH3CHO,H为苯酚,X为HCHO,根据
,根据F反推E为CH2=CHCOOH,D为CH3CHClCOOH或ClCH2CH2COOH,C为CH3CHClCHO或ClCH2CH2CHO,B为CH2=CHCHO,H和A发生反应推出A为CH3CHO,H为苯酚,X为HCHO,根据![]() 与浓硝酸在浓硫酸作用下反应生成
与浓硝酸在浓硫酸作用下反应生成![]() ,
,![]() 与HCl在铁作用下反应生成
与HCl在铁作用下反应生成![]() 。
。
(1)B为CH2=CHCHO,其中官能团名称为碳碳双键、醛基,由于两者都易被氧化,因此先用银氨溶液检验醛基,再用酸性高锰酸钾检验碳碳双键,因此检验其官能团所需试剂先后顺序为ace;故答案为:碳碳双键、醛基;ace。
(2)F(CH2=CHCOCl)与I(![]() )反应,根据产物分析得到反应类型是取代反应,吡啶是一种有机碱,其作用为防止氨基被氧化;故答案为:取代反应;防止氨基被氧化。
)反应,根据产物分析得到反应类型是取代反应,吡啶是一种有机碱,其作用为防止氨基被氧化;故答案为:取代反应;防止氨基被氧化。
(3)![]() 与A反应的化学方程式
与A反应的化学方程式 ;故答案为:
;故答案为: 。
。
(4)含有两种官能团,能发生银镜反应,说明有醛基,苯环上的一氯代物有两种,其同分异构体为 ;故答案为:
;故答案为: 。
。
(5)![]() 在酸性高锰酸钾作用下反应生成苯甲酸,苯甲酸和PCl3反应生成
在酸性高锰酸钾作用下反应生成苯甲酸,苯甲酸和PCl3反应生成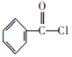 ,甲苯和浓硝酸、在浓硫酸加热条件下反应生成
,甲苯和浓硝酸、在浓硫酸加热条件下反应生成![]() ,
,![]() 和Fe、HCl反应生成
和Fe、HCl反应生成![]() ,
,![]() 与
与![]() 反应生成
反应生成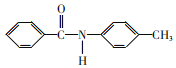 ;其合成路线为
;其合成路线为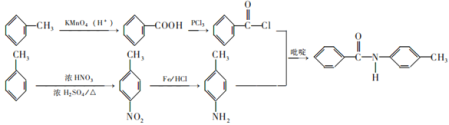 ;故答案为:
;故答案为: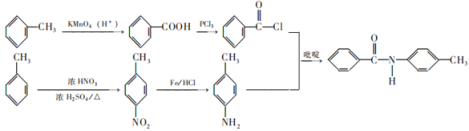 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)有机物命名:
![]() __________;
__________;
![]() ___________;
___________;
(2)依据名称写出物质:3,4-二甲基-4-乙基庚烷________;
(3)在下列有机物中①CH3CH2CH3②CH3CH=CH2③CH3-C![]() CH④
CH④![]() ⑤(CH3)2CHCH3⑥
⑤(CH3)2CHCH3⑥ 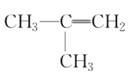 ⑦
⑦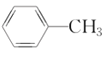 ⑧
⑧ ⑨
⑨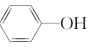 ⑩CH3CH2Cl中属于饱和烃的是_______,属于苯的同系物的是_____,互为同分异构体的是________。
⑩CH3CH2Cl中属于饱和烃的是_______,属于苯的同系物的是_____,互为同分异构体的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铂丝按如图进行氨的催化氧化实验,下列说法正确的是( )
A.通入空气的目的是让氨挥发出来,从而使氧气和氨充分混合
B.瓶口出现少量红棕色气体,说明氨催化氧化的产物是NO2
C.瓶内有白烟出现是由于生成了白色晶体NH4NO3
D.铂丝保持红热说明该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
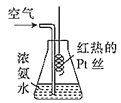
【题目】室温下,用0.1mol·L-1的NaOH溶液分别滴定20mL、浓度均为0.1mol·L-1的HCl溶液和HCOOH溶液,溶液中由水电离出的氢离子浓度的对数[1gc(H+)水]随加入NaOH溶液体积的变化如图所示(忽略溶液体积变化),下列说法正确的是( )
A.该温度下HCOOH的电离常数为Ka=1×10-5
B.a、c两点对应溶液同时升高相同温度,![]() 增大
增大
C.在c点溶液中有:c(HCOO-)+c(HCOOH)=0.1mol·L-1
D.在a、b、c、d四点中对应的溶液呈中性的为a、b、d
查看答案和解析>>
科目:高中化学 来源: 题型:
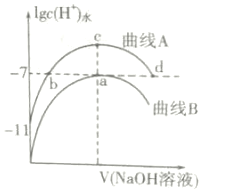
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
‘
(1)该密闭容器的容积是______________L。
(2)达到平衡状态的时刻是_______________min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=_____________mol/(L·min)。
(CO2)=_____________mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为______。
(5)该温度下,反应的化学平衡常数数值是____。
(6)已知: ① CO(g)+2H2(g) ![]() CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g) ![]() CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ.
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____,反应在10 min内所放出的热量为_____kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
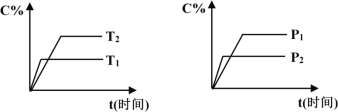
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出142.9kJ热量。则H2燃烧的热化学方程式为_____
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4kJ/mol
2NH3(g);ΔH=-92.4kJ/mol
①一定条件下,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示,其中加入催化剂引起反应速率变化的时间段是____(填,如0~t1等)。
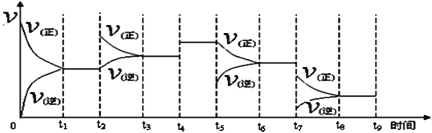
②生产中为提高反应速率和H2的转化率,下列措施可行的是___(填字母)。
A.向装置中充入过量N2 B.及时将合成的氨气从装置中分离出来
C.使用更高效的催化剂 D.升高温度
③温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液480 mL,根据这种溶液的配制情况回答下列问题:
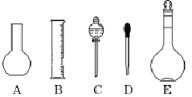
(1)如图所示的仪器中配制溶液肯定不需要的是__________ (填序号),仪器C的名称是__________,本实验所需玻璃仪器E规格为_____ mL。
(2)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)在配制NaOH溶液实验中,若出现如下情况,其中将引起所配溶液浓度大于0.1mol/L的是_________;(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(2)中步骤A
④加蒸馏水时不慎超过了刻度,立即用胶头滴管将多余的水吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀 | 蛋白质发生了盐析 |
B | SO2通入Ba(NO3)2溶液中,产生白色沉淀 | 沉淀为BaSO3 |
C | 向蔗糖中加入适量浓硫酸并搅拌,蔗糖变黑,体积膨胀,并放出刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
D | 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 | 碳酸酸性强于苯酚 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com