
【题目】(1)下图中甲池的总反应式为N2H4+O2===N2+2H2O。甲池中负极上的电极反应式为_________,乙池中石墨电极上发生的反应为_______________。甲池中每消耗0.1 mol N2H4,乙池电极上则会析出_________ g固体。

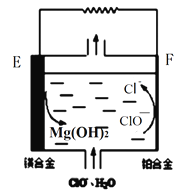
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的_______极(填“正”或“负”)。F电极上的电极反应式为______________。
(3)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。S(g)在负极生成SO3的电极反应式为____________________。已知S(g)在负极发生的反应为可逆反应,为提高硫蒸气的转化率,该工艺采取的措施有____________(任写一条)。

【答案】N2H4+4OH--4e-===N2+4H2O 2H2O-4e-===O2↑+4H+或4OH--4e-===2H2O+O2↑ 12.8 负 ClO- + 2e- + H2O = Cl-+ 2OH- S- 6e- +3O2- = SO3 硫磺(二氧化硫)循环使用;用稀硫酸吸收SO3(减小生成物浓度,有利于提高S转化率)
【解析】
(1)甲池为燃料电池,N2H4失电子生成氮气;乙池为电解池,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应;根据电路中每个电极得失电子守恒计算;
(2)原电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,据此图示判断正负极,并书写电极反应式;
(3)根据图示,S转化为SO2和SO3,发生氧化反应,结合电解质为固体金属氧化物书写电极反应式;结合平衡移动原理分析提高转化率的方法。
(1)甲池为燃料电池,负极上发生氧化反应,电极反应式为N2H4-4e-+4OH-=N2+4H2O;乙池为电解池,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应,反应式为4OH--4e-=2H2O+O2↑;甲池中每消耗0.1molN2H4,则根据负极N2H4-4e-+4OH-=N2+4H2O,转移0.4mol电子,所以乙池电极上则会析出![]() ×64g/mol=12.8g铜,故答案为:N2H4-4e-+4OH-=N2+4H2O;4OH--4e-=2H2O+O2;12.8。
×64g/mol=12.8g铜,故答案为:N2H4-4e-+4OH-=N2+4H2O;4OH--4e-=2H2O+O2;12.8。
(2)①燃料电池中,负极上燃料失电子发生氧化反应,化合价升高,正极上氧化剂得电子发生还原反应,化合价降低,根据图知,Mg元素化合价由0价变为+2价、Cl元素化合价由+1价变为-1价,所以E是负极、F是正极,正极上次氯酸根离子得电子和水反应生成氯离子和氢氧根离子,电极反应式为ClO-+2e-+H2O═Cl-+2OH-,故答案为:负;ClO-+2e-+H2O═Cl-+2OH-;
(3)根据图示,S转化为SO2和SO3,S元素的化合价升高,发生氧化反应,则S为负极,通氧气一端为正极,S(g)在负极生成SO2和SO3的电极反应式为S-4e-+2O2-=SO2、S-6e-+3O2-=SO3;若提高转化率,则平衡正向移动,所以可采取硫磺(二氧化硫)循环使用或用稀硫酸吸收三氧化硫,故答案为:S-6e-+3O2-=SO3;硫磺(二氧化硫)循环使用;用稀硫酸吸收三氧化硫。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】高分子化合物H的合成路线如下:

已知:i. 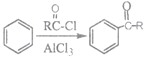
ii. 
回答下列问题
(1)A的化学名称为___________。
(2)B→C的化学方程式为______________________。
(3)E的结构简式为___________;由E生成F的反应类型为______________________。
(4)G中官能团名称为___________;由G→H的化学方程式为______________________。
(5)芳香族化合物L与G的官能团相同,但L的相对分子质量比G小28。则符合下列条件的L的同分异构体有___________种。
①与FeCl3溶液发生显色反应 ②苯环上有3个取代基
(6)按 有机合成路线可以制备
有机合成路线可以制备 。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
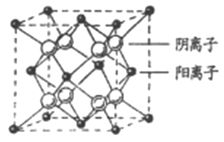
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置(气密性良好),若先将甲中液体滴入丙中,观察到气球明显鼓起,一段时间后恢复原状;再将乙中液体滴入丁中,气球又明显鼓起。下列组合正确的是( )

选项 | 滴管甲 | 烧杯丙 | 滴管乙 | 烧杯丁 |
A | 双氧水 | 二氧化锰 | 水 | 氢氧化钙 |
B | 稀硫酸 | 镁 | 盐酸 | 碳酸钙 |
C | 水 | 氢氧化钠 | 水 | 硝酸铵 |
D | 水 | 氧化钙 | 盐酸 | 镁 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有以下物质:①熔化的NaOH ②稀H2SO4溶液 ③KNO3 固体 ④汞(金属)⑤酒精(C2H5OH)溶液 ⑥干冰,请回答下列问题(用序号填空):
①属于电解质的是______________________;
②属于非电解质的是___________________。
(2)有四种物质是:①标况下6.72L CH4;②3.01×1023个HCl;③13.6g H2S;④0.2mol NH3,其中含有原子数最多的是_________,质量最大的是________。(用序号填空)
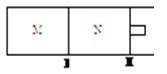
(3)如图所示,隔板I、Ⅱ均可自由移动,保持温度相同,若M容器中充入O2,N容器中充入SO2,若两容器中所含气体质量相等,则M容器和N容器的体积比为___________;若M容器中充入CO2,N容器中充入CO和H2两种混合气体,若隔板不再移动时两容器体积比为1:1, 则M,N容器中原子总数比为___________。
(4)标况下,体积_____L的CO气体含电子数与1.7克氢氧根离子OH- 含的电子数相同。
(5)9.5 g MCl2中含有Cl-的物质的量为0.2mol,则该氯化物的摩尔质量为________ g/mol,其中含M2+ 的质量为______g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略)。下列说法正确的是

A. 原子半径大小顺序:D>C>B>A B. 最简单气态氢化物的稳定性:B>C
C. 图示转化关系涉及的反应均为氧化还原反应 D. 元素C、D形成的化合物中一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aL体积比为1∶3的A、B两种链烃的混合气体,可与0.5aL(状态相同)氢气发生加成反应,则A、B两种链烃的通式可能是( )
A. CnH2n-2和CnH2n+2B. C nH2n和CnH2n+2
C. CnH2n和CnH2nD. CnH2n和CnH2n-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列有关说法正确的是

A. 1L0.1mol·L-1 NaHSO3溶液中含S原子的粒子个数为0.1NA
B. 标准状况下,6.72LNO2通入足量水中充分反应,转移电子数为0.6NA
C. 28gN4(如图所示)含N一N键数目为2NA
D. 1L0.5mol·L-1pH=7的CH3 COONH4溶液中NH4+数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当温度高于 500 K 时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。
(1)该反应的化学方程式为________________;其平衡常数表达式为K=________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.体系压强不再改变 b.H2的浓度不再改变 c.气体的密度不随时间改变 d.单位时间内消耗 H2和 CO2的物质的量之比为 3∶1
(3)已知:1 g 氢气完全燃烧生成液态水,放出 143 kJ 热量;23 g 乙醇完全燃烧生成液态水和二氧化碳,放出 650 kJ 热量,则氢气和乙醇的燃烧热的比值为________。(要求计算出数值)
(4)在一定压强下,测得由 CO2制取 CH3CH2OH 的实验数据中,起始投料比、温度与 CO2的转化率的关系如图所示,根据图中数据

①降低温度,平衡向________方向移动。
②在 700 K、起始投料比 n(H2)/n(CO2)=1.5 时,H2的转化率为________。
③在 500 K、起始投料比n(H2)/n(CO2)=2 时, 达到平衡后 H2的浓度为a mol·L-1,则达到平衡时 CH3CH2OH 的浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com