
【题目】NA代表阿伏加德罗常数的值。下列有关说法正确的是

A. 1L0.1mol·L-1 NaHSO3溶液中含S原子的粒子个数为0.1NA
B. 标准状况下,6.72LNO2通入足量水中充分反应,转移电子数为0.6NA
C. 28gN4(如图所示)含N一N键数目为2NA
D. 1L0.5mol·L-1pH=7的CH3 COONH4溶液中NH4+数目为0.5NA
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O
5Cl-+ClO3-+3H2O
该兴趣小组设计了下列实验装置,进行实验。

请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是____________________。
②该兴趣小组用100mL 12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2____________g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了![]() 、
、![]() 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。

①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为______________mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中![]() 的物质的量为0.37mol,则产物中
的物质的量为0.37mol,则产物中![]() =______________。
=______________。
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图中甲池的总反应式为N2H4+O2===N2+2H2O。甲池中负极上的电极反应式为_________,乙池中石墨电极上发生的反应为_______________。甲池中每消耗0.1 mol N2H4,乙池电极上则会析出_________ g固体。

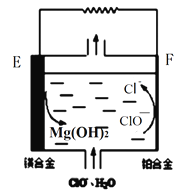
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的_______极(填“正”或“负”)。F电极上的电极反应式为______________。
(3)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。S(g)在负极生成SO3的电极反应式为____________________。已知S(g)在负极发生的反应为可逆反应,为提高硫蒸气的转化率,该工艺采取的措施有____________(任写一条)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理加以解释的是
A. 夏天,打开啤酒瓶时会在瓶口逸出气体
B. 浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C. 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D. 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)
(1)操作a的名称为___________,所需要的玻璃仪器为________________________。
(2)固体E的成分为_________________,加入的试剂④为________________,发生的化学方程式为__________________________________________。
(3)加入试剂①的目的是______________________________________________________。
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为_____________、冷却结晶、________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO![]() Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
Na2CO3+C(石量烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A. 该生产石墨烯的反应属于氧化还原反应
B. 石墨烯与金刚石互为同素异形体
C. Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D. 自然界中碳元素有游离态和化合态两种存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二甲胺[(CH3)2NH·H2O]是一元弱碱,其电离常数Kb=1.6×10-4。10 mL c mol·L-1二甲胺溶液中滴加0.1mo1·L-1盐酸,混合溶液的温度与盐酸体积的关系如图所示。下列说法不正确的

A. 二甲胺溶液的浓度为0.2mol·L-1
B. 在Y和Z点之间某点溶液pH=7
C. Y点存在:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. 常温下,(CH3)2NH2Cl水解常数Kh≈5.0×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氨气极易溶于水,因此液氨可作制冷剂
B. 浓硝酸遇到铁、铝会钝化,在任何情况下都不反应
C. 稀硝酸和铜反应需要加热
D. 碳铵,指的是碳酸氢铵,受热易分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com