
【题目】常温下,二甲胺[(CH3)2NH·H2O]是一元弱碱,其电离常数Kb=1.6×10-4。10 mL c mol·L-1二甲胺溶液中滴加0.1mo1·L-1盐酸,混合溶液的温度与盐酸体积的关系如图所示。下列说法不正确的

A. 二甲胺溶液的浓度为0.2mol·L-1
B. 在Y和Z点之间某点溶液pH=7
C. Y点存在:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. 常温下,(CH3)2NH2Cl水解常数Kh≈5.0×10-11
【答案】B
【解析】
A、溶液温度最高,即Y点表示酸碱恰好完全反应;
B、二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性,X点对应的溶液中(CH3)2NH·H2O、(CH3)2NH2Cl的浓度相等,其混合溶液呈碱性,故中性点应在X点与Y点之间;
C、二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性;
D、Kh=Kw/Kb=1×10-14/1.6×10-4≈5.0×10-11;
A、二甲胺与盐酸恰好完全中和时放出热量最多,溶液温度最高,即Y点表示酸碱恰好完全反应。根据(CH3)2NH·H2O+HCl=(CH3)2NH2Cl+H2O,c=0. 2mol·L-1,故A项正确;
B、二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性,X点对应的溶液中(CH3)2NH·H2O、(CH3)2NH2Cl的浓度相等,其混合溶液呈碱性,故中性点应在X点与Y点之间,故B错误;
C、二甲胺是弱碱,Y点对应溶质是强酸弱碱盐,其溶液呈酸性,Y点存在:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-),故C正确;
D、Kh=Kw/Kb=1×10-14/1.6×10-4≈5.0×10-11,故D正确;
故选B。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
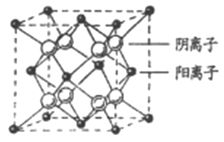
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aL体积比为1∶3的A、B两种链烃的混合气体,可与0.5aL(状态相同)氢气发生加成反应,则A、B两种链烃的通式可能是( )
A. CnH2n-2和CnH2n+2B. C nH2n和CnH2n+2
C. CnH2n和CnH2nD. CnH2n和CnH2n-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列有关说法正确的是

A. 1L0.1mol·L-1 NaHSO3溶液中含S原子的粒子个数为0.1NA
B. 标准状况下,6.72LNO2通入足量水中充分反应,转移电子数为0.6NA
C. 28gN4(如图所示)含N一N键数目为2NA
D. 1L0.5mol·L-1pH=7的CH3 COONH4溶液中NH4+数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)![]() zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3 mol·L-1。则下列有关判断正确的是 ( )
zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3 mol·L-1。则下列有关判断正确的是 ( )
A. B的转化率一定减小 B. x+y>z+m
C. 平衡向正反应方向移动 D. 混合气体的密度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为将含有的FeCl3、FeCl2、CuCl2的废液中的Cu2+还原回收,某同学在含有ag铁粉的容器中加入废液,探究了加入废液体积与完全反应后体系中固体质量的关系,部分实验数据如下表所示。已知:废液中c(Cu2+)=0.7 mol·Lˉ1;废液体积大于0.5L,充分反应后才能检测出Cu2+。

下列说法不正确的是
A. 当铁粉与0.25L废液反应完全后,固体成分为Fe与Cu
B. 当铁粉与1L废液反应完全后,再加入废液时发生的离子反应为Fe +2Fe3+=3Fe2+
C. 废液中c(Fe3+)=0.2 mol·Lˉ1
D. 要将1L废液中的Cu2+全部还原,则至少需要铁粉44.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当温度高于 500 K 时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。
(1)该反应的化学方程式为________________;其平衡常数表达式为K=________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.体系压强不再改变 b.H2的浓度不再改变 c.气体的密度不随时间改变 d.单位时间内消耗 H2和 CO2的物质的量之比为 3∶1
(3)已知:1 g 氢气完全燃烧生成液态水,放出 143 kJ 热量;23 g 乙醇完全燃烧生成液态水和二氧化碳,放出 650 kJ 热量,则氢气和乙醇的燃烧热的比值为________。(要求计算出数值)
(4)在一定压强下,测得由 CO2制取 CH3CH2OH 的实验数据中,起始投料比、温度与 CO2的转化率的关系如图所示,根据图中数据

①降低温度,平衡向________方向移动。
②在 700 K、起始投料比 n(H2)/n(CO2)=1.5 时,H2的转化率为________。
③在 500 K、起始投料比n(H2)/n(CO2)=2 时, 达到平衡后 H2的浓度为a mol·L-1,则达到平衡时 CH3CH2OH 的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,不合理的是( )

A. 洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干
B. 用CCl4提取碘水中的碘,选③
C. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D. 粗盐提纯,选①和②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com