
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
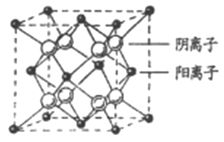
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
【答案】+2 [Ar]4s2 F>O>P sp3 正四面体形 109°28′ SO42-、CCl4等 12 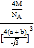 MgO>CaO Mg2+半径比Ca2+小,晶格能较大
MgO>CaO Mg2+半径比Ca2+小,晶格能较大
【解析】
根据处于同一电子层内相邻电子的电离能相差不大,不同电子层内相邻电子的电离能相差较多分析;结合原子核外电子排布规律书写其基态原子电子排布式;利用元素的非金属性越强,电负性越大,分析该物质中的元素电负性大小;根据微粒的空间构型、等电子体概念分析判断PO43-的结构,并学会运用晶胞结构中微粒的相对位置,判断微粒距离及晶体密度大小,利用微粒半径大小分析物质的硬度和熔沸点关系,据此解答。
(1) 根据元素M的气态原子的第I1-I5电离能大小可以看出:I1、I2相差不大,二I2、I3电离能相差较多,说明M原子最外层有2个电子。在Ca5(PO4)3中元素有Ca、P、O三种元素,只有Ca元素最外层有2个电子,原子半径大,容易失去最外层的2个电子,化合价为+2价;根据原子核外电子排布规律可知Ca基态原子电子排布式为[Ar]4s2或写为1s22s22p63s23p64s2;
(2)Ca3(PO4)3F中非金属元素有P、O、F三种,元素的非金属性F>O>P,元素的非金属性越强,其电负性就越大,所以按电负性由大到小的顺序排列为F>O>P;
(3) PO43-的中心原子P的价层电子对数是4,故P原子杂化为sp3杂化;由于孤对电子对数为0,该离子的空间构型为正四面体形,键角为109°28′,其等电子体有SO42-、CCl4;
(4)根据CaF2晶胞结构可知:在每个晶胞中与Ca2+离子距离最近且等距离的Ca2+有3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算了2次,所以与Ca2+离子距离最近且等距离的Ca2+有(3×8)÷2=12个;将CaF2晶胞分成8个小正方体,正方体中心为F-离子,顶点为Ca2+,晶胞中共有4个钙离子、8个氟离子。立方体的对角线为2(a+b),则晶胞的对角线为4(a+b),晶胞的边长为![]() ,根据晶体密度计算公式可得该晶体的密度
,根据晶体密度计算公式可得该晶体的密度![]() =
=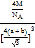 g/cm3;
g/cm3;
(5)MgO与CaO的晶体结构相似,由于离子半径Ca2+>Mg2+,离子半径越大,与O2-形成的离子键的键长就越大,晶格能就越小,物质的硬度就越小,故其摩氏硬度的大小关系为MgO>CaO。


科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L氨水中缓缓加蒸馏水稀释到1L后,下列说法不正确的是
A. 电离程度增大,导电能力减弱 B. c(OH- )/c(NH3 ·H2O)增大
C. 溶液中OH- 数目减小 D. Kb (NH3 ·H2O)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)写出步骤I中生成低浓度Br2的离子方程式______。
(2)步骤I中已获得Br2,步骤I中又将Br2还原为Br-,其目的为富集溴元素,请写出步骤II的化学方程式_______。
(3)在3mL溴水中加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为如图中的_______。

(4)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性,他们设计了如图装置简图。请你参与分析讨论:
①C中液体产物颜色为_____。
②用离子方程式解释NaOH浓溶液的作用______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O
5Cl-+ClO3-+3H2O
该兴趣小组设计了下列实验装置,进行实验。

请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是____________________。
②该兴趣小组用100mL 12mol/L盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2____________g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了![]() 、
、![]() 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。

①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为______________mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中![]() 的物质的量为0.37mol,则产物中
的物质的量为0.37mol,则产物中![]() =______________。
=______________。
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下十种物质:①稀H2SO4 ②纯醋酸(CH3COOH) ③NaOH溶液 ④FeCl3固体 ⑤CaCO3固体 ⑥CO2 ⑦熔融NaHSO4 ⑧Ba(HCO3)2溶液 ⑨乙醇(C2H5OH) ⑩NH3H2O
请回答下列问题
(1)其中能导电的是______________;其中属于非电解质的是_________________;属于弱电解质的是__________________。(填序号)
(2)将题中④物质溶于水配成饱和溶液,滴入沸水中,继续煮沸至出现红褐色可制得Fe(OH)3胶体,写出该过程的化学方程式_______________________________。
(3)按要求写出题中各物质发生反应的离子方程式
①与⑧反应___________________________________________;
②的水溶液与⑤的反应_______________________________________________;
③与⑦的水溶液的反应________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠( NaAlH4)是有机合成的重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝氢化钠的一种工艺流程如下图所示:

注:SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2SixO8)沉淀。
(1)铝硅酸钠(Na2 Al2SixO4)可以用氧化物的形式表示其组成,形式为_______。
(2)“过滤I”中滤渣的主要成分有_______(填名称)。向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,发生反应的离子方程式为OH-+HCO3—===CO32—+H2O、__________________________。
(3)“电解I”的另一产物在1000℃时可与N2反应制备AIN,在这种产物中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,其原理如图所示。
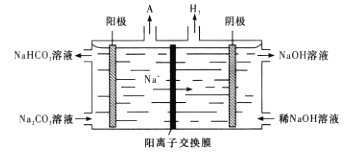
阳极的电极反应式为____________。已知F=96500C/mol,当I=0.5A时,通电80min,理论上阴极获得H2(标准状况下)的体积为_____L(结果保留两位有效数字)。
(5)铝氢化钠遇水发生剧烈反应,且反应产生大量气泡,其反应的化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图中甲池的总反应式为N2H4+O2===N2+2H2O。甲池中负极上的电极反应式为_________,乙池中石墨电极上发生的反应为_______________。甲池中每消耗0.1 mol N2H4,乙池电极上则会析出_________ g固体。

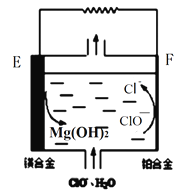
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的_______极(填“正”或“负”)。F电极上的电极反应式为______________。
(3)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。S(g)在负极生成SO3的电极反应式为____________________。已知S(g)在负极发生的反应为可逆反应,为提高硫蒸气的转化率,该工艺采取的措施有____________(任写一条)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二甲胺[(CH3)2NH·H2O]是一元弱碱,其电离常数Kb=1.6×10-4。10 mL c mol·L-1二甲胺溶液中滴加0.1mo1·L-1盐酸,混合溶液的温度与盐酸体积的关系如图所示。下列说法不正确的

A. 二甲胺溶液的浓度为0.2mol·L-1
B. 在Y和Z点之间某点溶液pH=7
C. Y点存在:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. 常温下,(CH3)2NH2Cl水解常数Kh≈5.0×10-11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com