
【题目】有以下十种物质:①稀H2SO4 ②纯醋酸(CH3COOH) ③NaOH溶液 ④FeCl3固体 ⑤CaCO3固体 ⑥CO2 ⑦熔融NaHSO4 ⑧Ba(HCO3)2溶液 ⑨乙醇(C2H5OH) ⑩NH3H2O
请回答下列问题
(1)其中能导电的是______________;其中属于非电解质的是_________________;属于弱电解质的是__________________。(填序号)
(2)将题中④物质溶于水配成饱和溶液,滴入沸水中,继续煮沸至出现红褐色可制得Fe(OH)3胶体,写出该过程的化学方程式_______________________________。
(3)按要求写出题中各物质发生反应的离子方程式
①与⑧反应___________________________________________;
②的水溶液与⑤的反应_______________________________________________;
③与⑦的水溶液的反应________________________________。
【答案】①③⑦⑧ ⑥⑨ ②⑩ FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 2H++SO42-+Ba2++2HCO3-= BaSO4↓+2H2O+2CO2↑ 2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ H++OH-=H2O
Fe(OH)3(胶体)+3HCl 2H++SO42-+Ba2++2HCO3-= BaSO4↓+2H2O+2CO2↑ 2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ H++OH-=H2O
【解析】
(1)含有自由移动电子或自由移动的离子的物质能导电;在水溶液和熔融状态下都不能导电的化合物是非电解质;在水溶液中能部分电离的化合物是弱电解质。
(2)FeCl3溶液加热煮沸生成氢氧化铁胶体和氯化氢;
(3)稀H2SO4与碳酸氢钡反应生成硫酸钡沉淀、水、二氧化碳气体;CaCO3固体与醋酸反应生成醋酸钙、水、二氧化碳气体;NaOH溶液与NaHSO4反应生成硫酸钠和水。
(1)①稀H2SO4是混合物,既不是电解质又不是非电解质,稀H2SO4含自由移动的离子,能导电;②纯醋酸(CH3COOH)在水溶液中部分发生电离,属于弱电解质,纯醋酸没有自由移动的离子,不导电;③NaOH溶液是混合物,既不是电解质又不是非电解质,NaOH溶液含自由移动的离子,能导电;④FeCl3固体在水溶液中发生完全电离,属于强电解质,FeCl3固体没有自由移动的离子,不导电;⑤CaCO3固体熔融状态下完全电离,属于强电解质,CaCO3固体没有自由移动的离子,不导电;⑥CO2自身不能电离出自由移动的离子,属于非电解质,不能导电;⑦NaHSO4在水溶液中完全电离,属于强电解质,熔融NaHSO4含有自由移动的离子,能导电;⑧Ba(HCO3)2溶液是混合物,既不是电解质又不是非电解质,Ba(HCO3)2溶液含自由移动的离子,能导电;⑨乙醇不能发生电离,属于非电解质,不含自由移动的离子,不能导电;⑩NH3H2O在水溶液部分电离,属于弱电解质,NH3H2O不含自由移动的离子,不能导电;所以其中能导电的是①③⑦⑧;属于非电解质的是⑥⑨;属于弱电解质的是②⑩。
(2)FeCl3溶液加热煮沸生成氢氧化铁胶体和氯化氢,反应方程式是FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(3)稀H2SO4与碳酸氢钡反应生成硫酸钡沉淀、水、二氧化碳气体,反应离子方程式是2H++SO42-+Ba2++2HCO3-= BaSO4↓+2H2O+2CO2↑;
CaCO3固体与醋酸反应生成醋酸钙、水、二氧化碳气体,反应离子方程式是2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑;
NaOH溶液与NaHSO4反应生成硫酸钠和水,反应离子方程式是H++OH-=H2O。


科目:高中化学 来源: 题型:
【题目】I.研究发现,氮氧化物和硫氧化物是雾霾的主要成分。回答下列问题:
(1)有下列反应:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
②C(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
③2C(s)+O(g)=2CO(g) △H3=-221.0 kJ/mol
已知某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式: _________________。
,请写出此反应的热化学方程式: _________________。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。

①下列说法正确的是___________(填正确选项的序号)
A.实验2容器内压强比实验1的小
B.由实验2和实验3可判断该反应是放热反应
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
E.在0→10mim内实验2的反应速率υ(O2)=0.015mol/(L·min)
②不能判断反应已达到化学平衡状态的是___________(填正确选项的序号)
A.容器内的气体压强不变 B.2υ正(NO2)=υ逆(O2)
C.气体的平均相对分子质量保持不变 D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为 P0kPa,在800℃温度下该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将___________(填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
(3)为了减少雾霾中的SO2,工业尾气中SO2可用饱和Na2SO3溶液吸收,该反应的化学方程式为___________;25℃时,若用1mol/L的Na2SO3溶液吸收SO2,当恰好完全反应时,溶液的pH___________7(填“大于”或“小于”或“等于”),溶液中各离子浓度由大到小的顺序为______________(已知:常温下H2SO3的电离常数Ka1=1.3×10-2,Ka2=6.2×10-8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式正确的是

A. Se(s)+ H2(g) = H2Se(g) ΔH=-242kJ·mol-1
B. Se(s)+ H2(g) = H2Se(g) ΔH=-20kJ·mol-1
C. Se(g)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
D. Se(s)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法错误的是
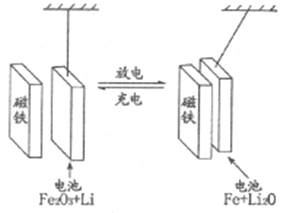
A. 放电时,负极的电极反应式为Li-e-=Li+
B. 放电时,电子通过电解质从Li流向Fe2O3
C. 充电时,Fe做阳极,电池逐渐摆脱磁铁吸引
D. 充电时,阳极的电极反应式为2Fe+3Li2O-6e-= Fe2O3+6Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
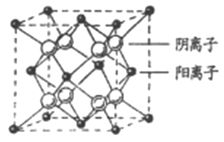
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有以下物质:①熔化的NaOH ②稀H2SO4溶液 ③KNO3 固体 ④汞(金属)⑤酒精(C2H5OH)溶液 ⑥干冰,请回答下列问题(用序号填空):
①属于电解质的是______________________;
②属于非电解质的是___________________。
(2)有四种物质是:①标况下6.72L CH4;②3.01×1023个HCl;③13.6g H2S;④0.2mol NH3,其中含有原子数最多的是_________,质量最大的是________。(用序号填空)
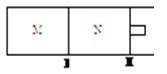
(3)如图所示,隔板I、Ⅱ均可自由移动,保持温度相同,若M容器中充入O2,N容器中充入SO2,若两容器中所含气体质量相等,则M容器和N容器的体积比为___________;若M容器中充入CO2,N容器中充入CO和H2两种混合气体,若隔板不再移动时两容器体积比为1:1, 则M,N容器中原子总数比为___________。
(4)标况下,体积_____L的CO气体含电子数与1.7克氢氧根离子OH- 含的电子数相同。
(5)9.5 g MCl2中含有Cl-的物质的量为0.2mol,则该氯化物的摩尔质量为________ g/mol,其中含M2+ 的质量为______g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)![]() zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3 mol·L-1。则下列有关判断正确的是 ( )
zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3 mol·L-1。则下列有关判断正确的是 ( )
A. B的转化率一定减小 B. x+y>z+m
C. 平衡向正反应方向移动 D. 混合气体的密度一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com