
【题目】下列说法正确的是
A.如不小心被同样温度的液态水和水蒸气烫伤,往往是被水蒸气烫伤更严重
B.所有有O2参与的反应都是放热反应
C.绝热密闭容器,中间活塞能自由移动,在两边各加入等量的反应物,发生如图的反应,反应达到平衡后,最终活塞仍处于正中间,则这两个反应放出或吸收的热量相同
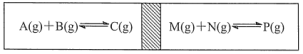
D.已知![]()
![]() ,则常温下
,则常温下![]() 完全燃烧放出的热量比
完全燃烧放出的热量比![]() 完全燃烧放出的热量多9kJ
完全燃烧放出的热量多9kJ
【答案】A
【解析】
A.相同质量的同一物质,内能:气态>液态,则相同质量相同温度的气态水内能大于液态水,所以不小心被同样温度的液态水和水蒸气烫伤,往往是被水蒸气烫伤更严重,故A正确;
B.有氧气参加的反应可能是吸热反应,如:3O2 ![]() 2O3为吸热反应,故B错误;
2O3为吸热反应,故B错误;
C.根据PV=nRT知,反应前后左右两侧的压强和体积相同,但是其气体总物质的量和温度成反比,所以反应后两个反应放出的热量或吸收的热量不一定相同,故C错误;
D.CH3CH2CH2CH3(g)=(CH3)2CHCH3(g)△H=-9.0kJmol-1,说明能量:CH3CH2CH2CH3(g)>(CH3)2CHCH3(g),烃的物质的量未知导致无法判断完全燃烧放出热量相对大小,故D错误;
故答案为A。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中间体M(2—甲基丙氨酸)的结构简式如图所示。下列有关M的说法错误的是

A.分子式为![]()
B.1molM与NaOH溶液反应,消耗lmolNaOH
C.分子中所有的碳原子不可能处于同一平面
D.与M含有相同官能团的同分异构体有5种![]() 不含本身,不考虑空间异构
不含本身,不考虑空间异构![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】透明聚酯玻璃钢可用于制造宇航员面罩和导弹达罩。制备橐酯的一种配方中含有中基丙烯酸甲酯(MMA,结构简式如图。下列有关MMA的说法正确的是

A. MMA易溶于水和有机溶剂
B. MMA的含氧官能团是羧基
C. MMA的一种同分异构体为CH3CH2 COOCH2CH3
D. MMA能发生加成反应、水解反应、氧化反应、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,W是同周期主族元素中原子半径最小的,下列说法正确的是
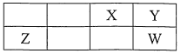
A.W位于第3周期Ⅶ族
B.原子半径![]()
C.Y的非金属性比W强,所以Y的最高价氧化物的水化物的酸性比W的强
D.X、Y、Z、W的简单氢化物中X的沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃料法测定某种氨基酸(CxHyOzNp)的分子式组成,取Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置置进行实验(铁架台、铁夹、酒精灯等未画出)。请回答有关问题:
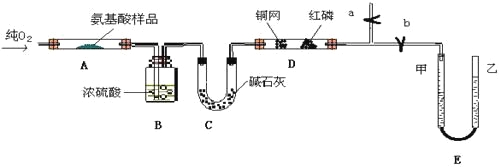
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通入一段时间的氧气,这样做的目的是______________________,之后关闭止水夹a。
(2)由装置B、C可分别确定待测氨基酸中含有的________和_______质量。
(3)E装置的作用是测量__________的体积,并由此确定待测氨基酸中含有的____________________的质量,为了较准确地测量该气体的体积。在读反应前后甲管中液面的读数求其差值的过程中,应注意____________(填代号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
(4)实验中测定的哪一数据可能不准确__________________________
其理由是_____________________________
(5)严格地说,按上述方案只能确定氨基酸的____________________。
若要确定此氨基酸的分子式,还要测定该氨基酸的______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)甲烷和氯气在光照条件下发生卤代反应,其反应机理如下:
反应①:![]() △H=242.7kJ·mol-1
△H=242.7kJ·mol-1
反应②:![]() △H=7.5kJ·mol-1
△H=7.5kJ·mol-1
反应③:![]() △H=-112.9kJ·mol-1
△H=-112.9kJ·mol-1
反应②、③反复循环,反应物浓度逐渐降低,自由基逐渐消失,反应停止。
(1)在该反应条件下断裂1mol CH3Cl中C—Cl键,需要吸收的能量为______。
(2)反应②与反应③的反应过程,如下图所示:
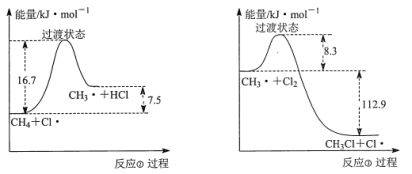
则该条件下,反应②的速率______反应③的速率(填“>”、“<”或“=”)。
(3)根据以上的反应机理,我们可以推测甲烷和氯气在光照条件下反应,除生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,原因是______。
(二)煤燃烧排放的SO2和NO2可形成严重的大气污染,某兴趣小组提出利用反应![]() 来处理。
来处理。
(4)在一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,达到平衡时NO2和SO2的体积之比为1:5,则该温度下平衡常数K为______。
(5)若向绝热恒容密闭容器中通入SO2和NO2,v正随时间变化如下图。下列结论正确的是______。
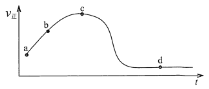
A. a点颜色比b点深
B. c点正反应速率等于逆反应速率
C. 若升高温度,d点SO2的转化率将增大
D. 反应的过程中,容器内气体压强保持不变
E. 若外界条件不发生改变,d点NO2和NO的体积比将保持不变
(6)若用一定浓度的NaClO2溶液(已调节其初始pH为5)充分吸收煤燃烧排放的烟气后,测得溶液中各物质的浓度如下表所示:

其中 NaClO2溶液吸收SO2的主要离子反应方程式为______。
(7)为消除NOx,科学家开发了一种能传导O2-的固态高温陶瓷电池,一极通氨气,另一极通NOx,生成无污染的常见气体和液体。写出该电池的正极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
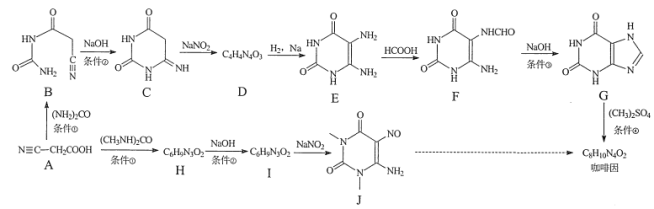
【题目】某研究小组按下列两条线合成咖啡因:
已知:R1-NH-R2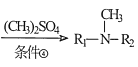 ,请回答:
,请回答:
(1)下列说法正确的是____。
A. 化合物A能与碳酸氢钠反应产生气体
B. 化合物C在酸性条件下水解,加热后有CO2产生
C. 化合物E到F的反应为酯化反应
D. 化合物J的分子式是C6H10N4O3
(2)化合物D的结构简式是______。
(3)写出H→I的化学方程式______。
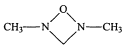
(4)化合物(CH3NH2)2CO的同分异构体的1H—NMR谱显示分子中只有2种化学环境不同的氢原子,符合要求的结构简式如图,除这三种外,还有______。
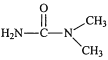 、
、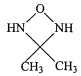 、
、
(5)根据题目所提供的信息,请设计J→咖啡因的合成路线(用流程图表示,无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
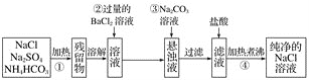
如果此方案正确,那么:
(1)操作①可选择_______仪器。
(2)操作②是否可改为加硝酸钡溶液__________,原因是___________。
(3)进行操作②后,判断硫酸根离子已除尽的方法是_____________。
(4)操作③的目的是_______,不先过滤后加碳酸钠溶液的理由是__________。
(5)操作④的目的是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com