
| 1 |
| 2 |
| 1 |
| 2 |
| 70.75KJ |
| 283KJ |
| 1mol×4 |
| 2 |


科目:高中化学 来源: 题型:
| A、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| B、钠与水的反应:Na+2H2O=Na++2OH-+H2↑ |
| C、等体积、等物质的量浓度的NaHCO3溶液和Ca(OH)2溶液混合:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+H2O |
| D、Al(NO3)3溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2LN2含有的分子数为0.5NA |
| B、71gCl2 所含原子数为2 NA |
| C、2L 0.3mol/L K2SO4溶液中K+浓度为1.2mol/L |
| D、标况下,1molO2与22.4LH2O中所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
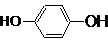



查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向25mL 0.1mol?L-1 MOH 溶液中逐滴加入0.2mol?L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol?L-1 MOH 溶液中逐滴加入0.2mol?L-1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、反应①是置换反应 |
| B、反应②是复分解反应 |
| C、①中TiO2是氧化剂 |
| D、反应②中金属镁是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com