
【题目】下列示意图与对应的反应情况正确的是
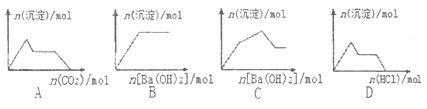
A. 含0.01molKOH和0.01molCa(OH)2的混合溶液中缓慢通入CO2
B. NaHSO4溶液中逐滴加入Ba(OH)2溶液
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D. Na[Al(OH)4]溶液中逐滴加入盐酸
【答案】B
【解析】A、CO2先与Ca(OH)2反应生成CaCO3沉淀,然后CO2与NaOH反应生成Na2CO3,此时沉淀还不会溶解减少,接下来CO2继续与Na2CO3反应生成NaHCO3,最后CO2与CaCO3反应,沉淀溶解直至完全消失,A错误。B 、NaHSO4溶液中逐滴加入Ba(OH)2溶液,Ba2+与SO42-一开始就生成BaSO4沉淀,至SO42-完全沉淀,沉淀的量不再变化,B正确。C、设KAl(SO4)2有1mol,则含有1molAl3+和2molSO42-,1molAl3+完全沉淀时消耗1.5mol Ba(OH)2,生成1molAl(OH)3沉淀,同时生成1.5molBaSO4沉淀,仍有0.5molSO42-未沉淀,此时沉淀的物质的量总共为2.5mol。再继续滴加Ba(OH)2时,设再滴加xmol Ba(OH)2,则继续生成xmolBaSO4沉淀,而将会溶解2xmol Al(OH)3沉淀,所以沉淀减少的物质的量大于生成的沉淀的物质的量,故总的沉淀的物质的量将减少,而不会再增加,因此,当沉淀的物质的量达到最大值时,再加Ba(OH)2,沉淀的物质的量是减小的,即沉淀的物质的量增加的曲线只有一段而不是两段,故C错误。D、Na[Al(OH)4]即NaAlO2,加入稀盐酸,AlO2-与H +先生成沉淀达到最大值,然后沉淀逐渐溶解至完全消失,D错误。正确答案为B。
点睛 :理解在复杂的体系中,确认化学反应先后顺序有利于解决问题。在复杂的非氧化还原反应体系中,先考虑酸(CO2相当于酸、H+)与碱(OH-)中和反应, 后考虑酸与盐之间或碱与盐之间的反应;在含有沉淀的悬浊液中滴加溶液或通入气体时,先考虑和体系中可溶的溶质反应,后考虑和体系中固体的反应;若是生成沉淀反应体系,则沉淀的溶度积或溶解度越小越容易发生反应生成沉淀;这些均符合强者优先反应的原则,谁强势谁胜利,谁强谁先反应。


科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 纤维素属于高分子化合物,与淀粉互为同分异构体,水解后均生成葡萄糖
B. 油脂的皂化和乙烯的水化反应类型相同
C. C3H6Cl2有四种同分异构体
D. 某有机物的结构简式是  ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应
,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉来源广泛、价格低康用其脱除烟气中SO2和NOx是目前研究的热点之一:
(1)脱除姻气中的SO2和NOx实验示意装置如图所示:图中N2和O2的作用______;装置A的作用是________。

(2)工业上用氯气与熟石灰制取漂白粉的化学方程式为________。
(3)用漂白粉溶液同时脱硫脱硝时,测得相同条件下SO2和NO的脱除率随时间变化如图所示:

①SO2的脱除率总是比NO的大,除因为脱除NO的活化能较高外,另一原因是__________。
②漂白粉溶液与过量SO2反应(同时有沉淀生成)的离子方程式为___。
(4)脱硝过程中包含一系列反应:2NO+O2=2NO2,2NO2+H2O![]() HNO2+HNO3,NO+HClO
HNO2+HNO3,NO+HClO![]() NO2+HCl等。
NO2+HCl等。
①实验测得吸收液初始pH与NO脱除率的关系如图所示:

i)在4<pH<10时,pH越小,NO脱除率越大,是因为________;
ii)当pH=12时,NO脱除率又增大,是因为________。
②为提高NO脱除率,在其他条件相同时,漂白粉溶液中分别添加三种不同添加剂,测得其对NO脱除率的影响如图所示。NO脱除率不同的原因是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的“神州七号”载人飞船已发射成功,“嫦娥”探月工程已正式启动.据科学家预测,月球的土壤中吸附着数百万吨的 ![]() He,每百吨
He,每百吨 ![]() He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以 ![]() He的形式存在.下列说法正确的是( )
He的形式存在.下列说法正确的是( )
A.![]() He原子核内含有4个质子
He原子核内含有4个质子
B.![]() He和
He和 ![]() He互为同位素
He互为同位素
C.![]() He原子核内含有3个中子
He原子核内含有3个中子
D.![]() He的最外层电子数为2,所以
He的最外层电子数为2,所以 ![]() He的化学性质活泼
He的化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E是原子序数依次增大前20号元素。A原子价电子层p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素。回答下列问题:
(1)A的元素符号为 ___________、 B3+的结构示意图为___________、C的最高价氧化物对应水化物为____________;E的价电子排布式为______________。
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是___________,(填写化学式)碱性最强物质的电子式为_____________; D所在周期(除稀有气体元素外)第一电离能最小的元素是_________;在AD3分子中A元素原子的杂化方式是__________,分子空间构型为_______________;
(3)准晶是一种无平移周期序但有严格准周期位置序的独特晶体,可通过____________方法区分晶体、准晶体和非晶体。
(4)C单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_____,列式表示Al单质的密度____________________g·cm﹣3(不必计算出结果)。
(5)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 天然气为纯净物 B. 天然气是不可再生的能源
C. 乙烯的结构简式为CH2CH2 D. 过量的CH4和Cl2在光照条件下反应只生成CH3Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中正确的是
A. 常温、常压下,32 g O2和O3混合气体中含有2NA个原子
B. 常温下,5.6 g铁粉加入足量浓硝酸中反应,转移的电子数为0.3NA
C. 1 L 0.5 mol·L-1Na2CO3溶液中,阴阳离子总数为1.5NA
D. 16 g CH4与18 g NH![]() 所含质子数相等
所含质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血的特效药。下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
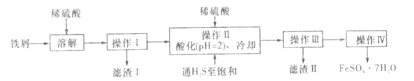
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)用KSCN检验绿矾晶体中是否含有Fe3+的离子方程式为:______________________。
(2)检验所得绿矾晶体中是否含有Fe3+的实验操作是_________。
(3)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是_________;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②______________________________。
(4)操作IV的顺序依次为:__________。
(5)操作IV得到的绿矾晶体需要洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4·7H2O的损耗。洗涤晶体的溶液可以是_____(填正确选项序号)。
a.冰水 b.饱和Na2SO4溶液 c.乙醇
(6)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时KMnO4溶液只与Fe2+发生反应)。
①计算上述样品中FeSO4·7H2O的质量分数为______(保留4位有效数字);
②若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com