
����Ŀ��Ư����Դ�㷺���۸�Ϳ������ѳ�������SO2��NOx��Ŀǰ�о����ȵ�֮һ:
��1���ѳ������е�SO2��NOxʵ��ʾ��װ����ͼ��ʾ:ͼ��N2��O2������______��װ��A��������________��

��2����ҵ������������ʯ����ȡƯ�۵Ļ�ѧ����ʽΪ________��
��3����Ư����Һͬʱ��������ʱ�������ͬ������SO2��NO���ѳ�����ʱ��仯��ͼ��ʾ:

��SO2���ѳ������DZ�NO�Ĵ���Ϊ�ѳ�NO�Ļ�ܽϸ��⣬��һԭ����__________��
��Ư����Һ�����SO2��Ӧ(ͬʱ�г�������)�����ӷ���ʽΪ___��
��4�����������а���һϵ�з�Ӧ:2NO+O2=2NO2��2NO2+H2O![]() HNO2+HNO3��NO+HClO
HNO2+HNO3��NO+HClO![]() NO2+HCl�ȡ�
NO2+HCl�ȡ�
��ʵ��������Һ��ʼpH��NO�ѳ��ʵĹ�ϵ��ͼ��ʾ:

i)��4<pH<10ʱ��pHԽС��NO�ѳ���Խ������Ϊ________��
ii)��pH=12ʱ��NO�ѳ�������������Ϊ________��
��Ϊ���NO�ѳ��ʣ�������������ͬʱ��Ư����Һ�зֱ��������ֲ�ͬ���Ӽ���������NO�ѳ��ʵ�Ӱ����ͼ��ʾ��NO�ѳ��ʲ�ͬ��ԭ����_________��

���𰸡� ���Ʋ�ͬ���������ģ������ �������� 2Cl2 +2Ca(OH)2= CaCl2+Ca(ClO)2+2H2O NO���ܽ�Ƚϵ� Ca2++ClO-+SO2+H2O =CaSO4��+2H++Cl- pH ��Сʱ������������HClO��NO����Ϊ�ϸ�̬�ĵ�������(��NO2) ���������������ڵ�������(NO2��NO��O2��NO��NO2��) ת������ ��������������KMnO4>H2O2>NaClO2����Ӧ��NO �ѳ���Ҳ��
����������1���ѳ������е�SO2��NOxʵ��ʾ��װ����ͼ��ʾ:ͼ��N2��O2������ ���Ʋ�ͬ���������ģ��������װ��A�������ǽ�����������2����ҵ������������ʯ����ȡƯ�۵Ļ�ѧ����ʽΪ2Cl2 +2Ca(OH)2= CaCl2+Ca(ClO)2+2H2O����3����SO2���ѳ������DZ�NO�Ĵ���Ϊ�ѳ�NO�Ļ�ܽϸ��⣬SO2����Һ�����ܣ���һԭ����NO���ܽ�Ƚϵͣ���Ư����Һ��ǿ�����ԣ������SO2��Ӧ����CaSO4�������ɣ����ӷ���ʽΪCa2++ClO-+SO2+H2O =CaSO4��+2H++Cl- ����4����i)��4<pH<10ʱ��pHԽС��NO�ѳ���Խ�������ȣ���������ǿ�������������ԣ�����pH ��Сʱ������������HClO��NO����Ϊ�ϸ�̬�ĵ�������(��NO2)��ii)��pH=12ʱ��NO�ѳ�������������Ϊ���������������ڵ�������(NO2��NO��O2��NO��NO2��) ת���������ڷֱ��������ֲ�ͬ���Ӽ���������NO�ѳ��ʵ�Ӱ�첻��ͬ����������������KMnO4>H2O2>NaClO2����Ӧ��NO �ѳ���Ҳ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ���������ȷ������ ��
A. ��ҩ��ȡ�÷�ĩ״���� B. ��ʢ��Ũ������ձ��м�������ˮ����ϡ��
C. �ý�ͷ�ιܵμ�����Һ�� D. ֱ����������þ������þ���ڿ����е�ȼ��ʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɳ�������ִ��������й㷺Ӧ�ã���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd+2NiOOH+2H2O![]() Cd��OH��2+2Ni��OH��2�йظõ�ص�˵����ȷ���ǣ�������
Cd��OH��2+2Ni��OH��2�йظõ�ص�˵����ȷ���ǣ�������
A. �ŵ�ʱ����������Һ�ļ��Բ���
B. �������ǻ�ѧ��ת��Ϊ���ܵĹ���
C. ���ʱ������Ӧ��Ni��OH��2��e��+OH���TNiOOH+H2O
D. �ŵ�ʱ�������Һ�е�OH���������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڹ��������£����Ը����鷢����ѧ��Ӧ����( )
A.����B.ϡ����C.�ռ�D.���������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס���Ϊ���ֲ�ͬ���ʵ��Ҵ�ȼ�ϵ��(����ͼ��ʾ)������˵����ȷ����

A. װ�ü��Ҿ��ǵ���ת��Ϊ��ѧ��
B. X��Z���Ϸֱ����ĵ����ʵ����Ҵ�ʱ�������ס��Ҹ��صĵ�������ͬ
C. Y��W�������������ʵ�����ͬʱ��X��Z�������Ҵ������ʵ���Ҳ��ͬ
D. Z���Ϸ����ĵ缫��ӦΪ:CH3CH2OH+5OH--4e-=CH3COO-+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���25 ��ʱijЩ����ĵ���ƽ�ⳣ����
��ѧʽ | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka��1.8��10��5 | Ka��3.0��10��8 | Ka1��4.1��10��7 Ka2��5.6��10��11 | Ka1��5.9��10��2 Ka2��6.4��10��5 |
��1��H2C2O4�뺬�����ʵ�����KOH����Һ��Ӧ��������Һ�����ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ_______________________________________��
��2����0.1 mol��L��1 CH3COOH��Һ�еμ�NaOH��Һ��c��CH3COOH����c��CH3COO������5��9����ʱ��ҺpH��________��
��3����̼������Һ�еμ�������ˮ�����ӷ���ʽΪ_____________________��
��4����0.1mol��L��1CH3COOH��Һ��0.1mol��L��1NaOH��Һ�������ϣ����Ի�Ϻ���Һ����ı仯������û����Һ��pH��8����c��Na+��-c��CH3COO����=_______________mol��L��1���ȷ����������
��5�� ��CH3COOH��Һ�����ʯ��Ӧ�������ı����44.8L����ȫ��ͨ�뵽2L 1.5mol/L��NaOH��Һ�г�ַ�Ӧ������Һ���������ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ں�ˮ��ѧ��Դ���õ��ǣ�������
A. ��ˮ���� B. ���ú�ˮ��ȴ C. ��ˮ���� D. ��ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʾ��ͼ���Ӧ�ķ�Ӧ�����ȷ����
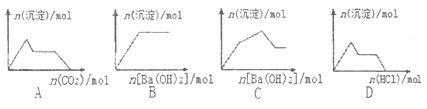
A. ��0.01molKOH��0.01molCa��OH��2�Ļ����Һ�л���ͨ��CO2
B. NaHSO4��Һ����μ���Ba��OH��2��Һ
C. KAl��SO4��2��Һ����μ���Ba��OH��2��Һ
D. Na[Al��OH��4]��Һ����μ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij����X������H2��CO��CH4�е�һ�ֻ�����ɣ���X����ȼ�գ���ȼ�պ����ɵ�����ͨ��A��B����ϴ��ƿ���Իش��������⣺ 
��1����Aϴ��ƿ���������ӣ�Bϴ��ƿ���������䣬������X�� ��
��2����Aϴ��ƿ���������䣬Bϴ��ƿ���������ӣ�������X�� ��
��3����A��B����ϴ��ƿ�����������ӣ�������X������ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com