
【题目】实验室用下图装置制取少量溴苯,试填写下列空白。
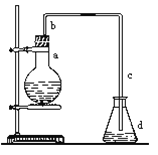
(1)在烧瓶a中装的试剂是铁粉、 和 。
(2)请你推测长直导管b的作用: ____ 。
(3)请你分析导管c的下口可否浸没于液面中?为什么?
。
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有 生成,
此现象说明这种获得溴苯的反应属于: 。(填有机反应类型)
【答案】(1)苯,Br2 (2)导气 冷凝和回流
(3)不能;HBr易溶于水很容易倒吸 (4)淡黄色沉淀;取代反应
【解析】试题分析:(1)实验室制取溴苯是以苯、液溴为原料,用铁粉作还原剂(实质上起催化剂作用的是溴化铁)制取的。故在烧瓶中应该装的试剂是铁粉、苯、Br2。
(2)该反应是放热反应,为减少液溴的挥发,所用的导管垂直于烧瓶的部分通常很长。这样长直导管b的作用一是导气,二是冷凝和回流。
(3)该反应是取代反应。除生成溴苯外,还产生HBr, HBr易挥发且易溶于水导管C不能浸没于液面,这样可防倒吸;
(4)HBr和AgNO 3溶液反应产生溴化银淡黄色沉淀,根据此实验现象可以说明该反应是取代反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:3A(g)+B(g) ![]() 2C(g) +2D(g) 在不同条件下的反应速率分别为:
2C(g) +2D(g) 在不同条件下的反应速率分别为:
(1)v(A)=0.6molL-1min-1 (2) v(B)=0.007 molL-1S-1
(3)v(C)=0.4 molL-1min-1 (4) v(D)=0.80 molL-1min-1
此反应在不同条件下进行最快的是 ( )
A.(1) B.(2) C.(3) D.(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g) ![]() H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ·mol-1
H3=198 kJ·mol-1
反应ZnS(s) + C(s) + 2O2(g)=Zn(g) + CO2(g) + SO2(g)的![]() H4= kJ·mol-1。
H4= kJ·mol-1。
(2)反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H﹤0
CO(NH2)2(s)+H2O(g)△H﹤0
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
若想提高氨气的转化率,可以采取的措施有 (写出两条)
(3)硫酸锌可广泛用作印染媒染剂和木材防腐剂。ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
①700℃~980℃时发生反应中生成物质二氧化硫、ZnO和氧气,如该反应在2L密闭容器内进行,10min时,测得生成的氧气的物质的量为0.3mol,则这段时间二氧化硫的生成速率为 。
② 硫酸锌分解生成的SO2经下图中的循环可得到H2SO4。循环中电解过程阳极反应式是 。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中充入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)△H=﹣57kJmol﹣1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化
N2O4(g)△H=﹣57kJmol﹣1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化
的曲线如图所示。下列说法正确的是( )

A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室用来验证乙烯与氢气反应产物的装置,请回答下列问题:

(1)方框内装置用来制取乙烯,其中包括的仪器和药品是:
①碎瓷片 ②石棉网和铁架台 ③圆底烧瓶 ④温度计(量程100℃)⑤温度计(量程200℃)⑥酒精灯 ⑦单孔塞 ⑧双孔塞⑨导管。不选用的仪器有 (填编号)。
写出制乙烯化学方程式:_____________________________,反应进行一段时间后,方框内装置中混合液常变黑,并伴有刺激性气味的气体产生,该气体是 ,若要验证有该气体生成,应将生成的气体通过 溶液。
(2)NaOH溶液的作用是___________________,碱石灰的作用是:_____________________。
(3)实验过程中,发现溴水会褪色,可能的原因是:________ _____。
(4)出现什么现象可说明生成了乙烷?_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M分子的球棍模型如图所示,以A为原料合成B和M的路线如下:

已知:A的相对分子质量为26。
(1)A的名称为____________ ,M的分子式为____________。
(2)环状烃B的核磁共振氢谱中只有一种峰,其能使溴的四氯化碳溶液褪色,则B的结构简式为____________。
(3)将1molE完全转化为F时,需要____________ molNaOH。
(4)G中的含氧官能团的名称是____________,写出由G反应生成高分子的化学反应方程式:____________。
(5)M的同分异构体有多种,则符合以下条件的同分异构体共有____________种。
①能发生银镜反应 ②含有苯环且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色
④1mol该有机物与足量钠反应生成1mol氢气(一个碳原子上同时连接两个-OH不稳定)
其中有一些经催化氧化可得三元醛,写出其中一种的结构简式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水生产的流程示意图见下:

(1)二氧化氯(ClO2)是一种高效、安全的水处理剂,比C12好。有如下两种制备C1O2方法:
方法一:2NaClO3+4HCl=2C1O2↑+Cl2↑+2NaCl+2H2O
方法二:2NaC lO3 +H2O2+H2SO4=2C lO2↑ +Na2SO4十O2↑+2H2O
用方法二制备的C1O2更适合用于饮用水消毒,其主要原因是__________。
C1O2和C12在消毒时自身均被还原为Cl-, C1O2的消毒能力是等质量Cl2的_________倍
(2)含有较多的钙、镁离子的水被称为硬水。暂时硬水最常见的软化方法是_________。
永久硬水一般可以使用离子交换树脂软化,先把水通过装有_________ (填“阴”或“阳”)离子交换树脂的交换柱,再通过另一种功能的离子交换树脂。使用后的阳离子交换树脂可以置于_________中再生。
(3)水处理中常见的混凝剂有硫酸铝、聚合氛化铝、硫酸亚铁、硫酸铁等。硫酸亚铁作为混凝剂在除去悬浮物质时,需要将水的pH调至9左右,原因是_________。
(4)电渗析法是一种利用离子交换膜进行海水淡化的方法.下图是电渗析法的示意图,淡水从_________(填“A”、“B”或,“C”)口流出,甲为_________离子交换膜。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是由四种短周期元素中的两种或三种组成的5种化合物,其中乙、丙、戊均由两种元素组成,丙是导致温室效应的主要气体,戊是天然气的主要成分,乙和丁都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;甲由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:

请回答下列问题:
(1)物质甲的化学式是 ,写出乙的一种用途是 。
(2)甲与足量H2O溶液反应的化学方程式 。
(3)将过量的丙通入某种物质的水溶液中可以生成丁,该反应的离子方程式为 。
(4)乙溶于某强碱溶液的离子方程式为 。
(5)在200 mL 1.5 mol·L-1NaOH溶液中通入标准状况下4.48 L 丙气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)丁是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol 丁投入1 L某浓度的盐酸中,为使丁完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组以甲酸为原料在实验室完成了一氧化碳和甲酸铜两种物质的制备实验。
实验一、用甲酸制备一氧化碳
CO的制备原理:HCOOH![]() CO↑+H2O,制备装置如下图(其中夹持仪器、加热仪器没有画出)
CO↑+H2O,制备装置如下图(其中夹持仪器、加热仪器没有画出)
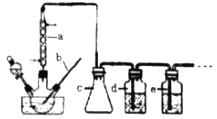
(1)b仪器的名称为___________,c的作用是___________。
(2)制备CO时,浓硫酸与甲酸的混合方式是___________。
实验二、用甲酸制备甲酸铜[Cu(HCOO)24H2O]
步骤一:碱式碳酸铜的制备
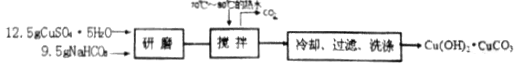
步骤二:甲酸铜的制备
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量甲酸至沉淀完全溶解,趁热过滤,滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)24H2O产品,称量,计算产率。回答下列问题:
左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)24H2O产品,称量,计算产率。回答下列问题:
(3)在制备碱式碳酸铜的过程中,如果温度过高,对产物有何影响?___________。
(4)步骤二中碱式碳酸铜滴入甲酸生成四水合甲酸铜的化学方程式为___________。
(5)本实验涉及三种固液分离的方法.
①倾析法使用到的仪器有___________;
②采用减压过滤的装置对步骤二中溶解后的溶液进行趁热过滤;
③步骤二的实验中,需用到下列装置___________

(6)最终称量所得的产品为7.91g,则产率为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com