
【题目】如图是FeS2催化氧化关系转化图,下列说法正确的是( )
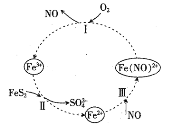
A.反应I中,还原剂为Fe2+
B.反应II中,FeS2既是氧化剂也是还原剂
C.反应III属于化合反应
D.FeS2催化氧化关系中,NO是催化剂
【答案】CD
【解析】
反应I为Fe(NO)2+与O2反应生成NO和Fe3+,反应的离子方程式为4Fe(NO)2++O2+4H+=4NO+4Fe3++2H2O,反应II为FeS2与Fe3+反应生成SO42—和Fe2+,反应的离子方程式为FeS2+14Fe3++8H2O=2SO42—+15Fe2++16H+,反应III为Fe2+与NO反应生成Fe(NO)2+,反应的离子方程式为Fe2++NO=Fe(NO)2+,总反应的离子方程式为FeS2+10Fe3++ O2+6H2O![]() 2SO42—+11Fe2++12H+。
2SO42—+11Fe2++12H+。
A项、由图可知,反应I为Fe(NO)2+与O2反应生成NO和Fe3+,氧化剂为O2,还原剂为Fe(NO)2+,故A错误;
B项、由图可知,反应II为FeS2与Fe3+反应生成SO42—和Fe2+,氧化剂为Fe3+,还原剂为FeS2,故B错误;
C项、由图可知,反应III为Fe2+与NO反应生成Fe(NO)2+,该反应属于化合反应,故C正确;
D项、FeS2催化氧化关系中,反应III中NO为反应物,反应I中NO为生成物,NO是反应的催化剂,故D正确;
故选CD;


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L1表示),写出计算过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图装置制得氯气并与铝粉反应制备无水AlCl3。已知AlCl3在183°C升华,遇潮湿空气即反应产生大量白雾。请回答问题:
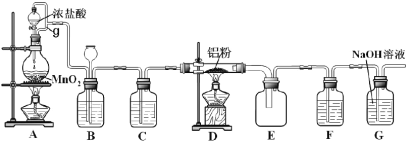
(1)A中反应的化学方程式为_________;HCl在反应中表现出的性质为______(填:酸性、氧化性或还原性)。
(2)A中g管的作用是________。
(3)B中盛放饱和食盐水的作用是________;若D中生成的AlCl3凝华堵塞导管,B中可观察到的现象为________。
(4)C和F所装试剂相同,其中F的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中常见的物质,已知C 为红棕色气体,它们之间的相互转化关系如下(部分反应条件及产物已略去)。

(1)若A为单质,则A的化学式为_________,试写出C→D反应的化学方程式:_________。
(2)A亦可为NH3,它与O2 在高温、催化剂的作用下反应生成B,此化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法不正确的是
A.5.5g超重水(T2O)中含有的中子数目为3NA
B.常温常压下,44gCO2与足量过氧化钠反应转移电子的数目为NA
C.常温常压下,42gC2H4和C4H8混合气体中含有氢原子的数目为6NA
D.0.1L0.5mol·L-1CH3COOH溶液中含有H+数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则该结构的烃的一氯取代物最多可能有的种类(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有的种类(不考虑立体异构)
A. 9B. 6C. 5D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某烃的分子式为C5H12,符合该分子式的同分异构体有3种,其中一卤代物有一种结构,此烃的结构简式为:_________________ .用系统法命名: ________________.
Ⅱ.已知乳酸的结构简式为 ![]() .试回答:
.试回答:
(1)乳酸分子中含有_____________和____________两种官能团(写名称);
(2)乳酸与金属钠溶液反应的化学方程式______________________________
(3)乳酸与Na2CO3溶液反应的化学方程式为_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O

请回答:
(1)甲池是___,通入O2的电极作为___极,电极反应式为_______.
(2)乙池是_____,A电极名称为__极,电极反应式为_________.
乙池中的总反应离子方程式为_________,一段时间后溶液的pH______(填“增大”、“减小”或“不变”).
(3)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2____mL(标准状况下).当丙为硫酸铜溶液且体积为500 mL,通电后丙溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解Na2SO4溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。下列说法正确的是( )
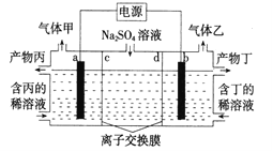
A.b 极与电源的正极相连
B.产物丙为NaOH 溶液
C.离子交换膜d 为阴离了交换膜(允许阴离子通过)
D.a 电极反应式为2H2O-4e-=4H++O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com