
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;其中E元素为原子半径最小的元素,且A、C同周期,B和C同主族;A与B可形成离子化合物A2B,其含有的离子具有相同的电子层结构,且电子总数为30;D和E可形成4核10电子分子,该分子可使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)C元素的元素符号为________;
(2)B、D元素的第一电离能大小关系为:B_____D(填“<”、“>”或“=”);
(3)写出D元素形成的单质的结构式为______________,其中σ键:π键=______。
(4)A2B对应的水化物的碱性比LiOH _______(填“强”或“弱”);化合物A2B2属于_______(选“离子”或“共价”)化合物,写出A2B2的电子式_________________,A2B2溶于水时发生反应的化学方程式为__________________________________________________
(5)化合物E2B、E2C,它们结构与组成相似,热稳定性更强的是__________(填化学式)
但E2B的沸点比E2C高得多的原因是___________________________________。
【答案】 S < N≡N 1:2 强 离子 ![]() 2Na2O2+2H2O=4NaOH+O2↑ H2O 水分子间存在氢键
2Na2O2+2H2O=4NaOH+O2↑ H2O 水分子间存在氢键
【解析】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;其中E元素为原子半径最小的元素,D和E可形成4核10电子分子,该分子可使湿润的红色石蕊试纸变蓝,则为氨气,故D为氮元素、E为氢元素; A与B可形成离子化合物A2B,其含有的离子具有相同的电子层结构,且电子总数为30,则A为钠元素、B为氧元素;A、C同周期,B和C同主族,则C为硫元素;(1)C为硫元素,元素符号为S;(2)N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是O<N;(3)N元素形成的单质N2的结构式为N≡N,其中σ键:π键=1:2;(4)同主族金属元素的最高价氧化物的水化物的碱性从上而下增强,故A2B对应的水化物NaOH的碱性比LiOH强;化合Na2O2属于离子化合物, 其电子式为![]() ,Na2O2溶于水时发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;(5)化合物H2O、H2S,它们结构与组成相似,非金属性越强氢化物的稳定性越强,故热稳定性更强的是H2O;但H2O的沸点比H2S高得多的原因是水分子间存在氢键。
,Na2O2溶于水时发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;(5)化合物H2O、H2S,它们结构与组成相似,非金属性越强氢化物的稳定性越强,故热稳定性更强的是H2O;但H2O的沸点比H2S高得多的原因是水分子间存在氢键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知PbS、CuS、HgS的溶度积分别为9.0×10-29、1.3×10-36、4×10-53。下列说法正确的是
A. 硫化钠可作处理废水中含上述金属离子的沉淀剂
B. 在硫化铜悬浊液中滴几滴硝酸铅溶液,会生成硫化铅
C. 在含Pb2+、Cu2+、Hg2+的溶液中滴加硫化钠溶液,当溶液中c(S2-)=0.001mol/L时三种金属离子不能都完全沉淀
D. 向含Pb2+、Cu2+、Hg2+的浓度均为0.010mol/L的溶液中通入硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl﹣、SO42-和NO3﹣的相互分离。相应的实验过程可用下图表示:
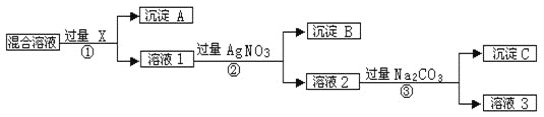
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___________,沉淀C______________。
(2)按此实验方案得到的溶液3中肯定含有杂质;为了解决这个问题,可以向溶液3中加入适量的____________。
(3)上述实验流程中加入过量的AgNO3,确认AgNO3已过量的实验方法是________________________。
(4)写出步骤①中发生反应的离子方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石英晶体的平面示意图如图所示,它实际上是网状结构,其中硅、氧原子的个数比是m:n,有关叙述正确的是( )(相对原子量Si 28 O 16)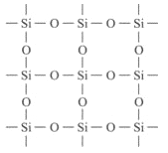
A. 6g该晶体中含有0.1NA个分子
B. m:n=2:1
C. 原硅酸根SiO44—的结构为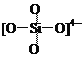 ,则二聚硅酸根离子Si2O7x—中的x=6
,则二聚硅酸根离子Si2O7x—中的x=6
D. 六聚硅酸根[Si6O18]y—中的y=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向浓度均为0.10mol/L、体积均为1mL的NaOH溶液和Na2CO3溶液中分别加水,均稀释至VmL,两种溶液的pH与lgV的变化关系如图所示。下列叙述中错误的是
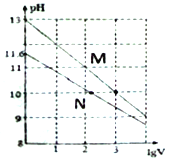
A. Ka1(CO32-)(Ka1为第一级水解平衡常数)的数量级为10-4
B. 曲线N表示Na2CO3溶液的pH随lgV的变化关系
C. Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D. 若将Na2CO3溶液加热蒸干,由于CO32-水解,最终析出的是NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体的晶胞结构如图。(该晶胞可看成由8个小立方体构成,在每个小立方体的体心各有一个黑球,在大立方体的8个顶点和6个面心上各有一个白球)试求:
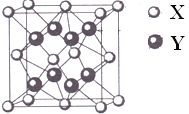
①晶体中每一个Y同时吸引着_____个X,每个X同时吸引着______个Y,该晶体的化学式是____________。
②晶体中在每个X周围与它最接近且距离相等X共有_____个。
③晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为___________。
④设该晶体的摩尔质量为M g/mol,晶胞密度为ρg/cm3,阿伏加德罗常数为NA,则晶体中两个最近的X间中心距离为____________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3 + 5O2 = 4NO + 6H2O,若反应速率分别是ν(NH3)、ν(O2)、ν(NO)、ν(H2O气)(单位:molL-1min-1)。下列关系正确的是 ( )
A. 4/5ν(NH3)=ν(O2) B. 5/6ν(O2)=ν(H2O)
C. 2/3ν(NH3)=ν(H2O) D. 4/5ν(O2)=ν(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁) > r(乙) > r(丙) > r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A. 丙的简单氢化物分子内存在氢键
B. 由甲、乙两元素组成的化合物中,只含有极性键
C. 由甲和丙两元素组成的分子不止一种
D. 乙和丁两元素的最高价氧化物的水化物之间能发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com