
【题目】石英晶体的平面示意图如图所示,它实际上是网状结构,其中硅、氧原子的个数比是m:n,有关叙述正确的是( )(相对原子量Si 28 O 16)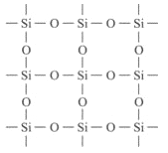
A. 6g该晶体中含有0.1NA个分子
B. m:n=2:1
C. 原硅酸根SiO44—的结构为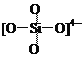 ,则二聚硅酸根离子Si2O7x—中的x=6
,则二聚硅酸根离子Si2O7x—中的x=6
D. 六聚硅酸根[Si6O18]y—中的y=10
科目:高中化学 来源: 题型:
【题目】高分子化合物G的一种合成路线如下:

已知:①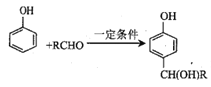 ;
;
②D溶液显酸性
③浓硫酸能与酚类物质发生取代反应,在苯环上引入-SO2H
回答下列问题:
(1)E分子中的含氧官能团名称为____________________________。
(2)下列关于化合物B的说法不正确的是______________ (填标号)。
①苯环上一氯代物有2种
②分子式为C8H10O2
③既能与FeCl3溶液发生显色反应又能与溴水发生加成反应
④1mol化合物B与足量金属钠反应生成标准状况下氢气22.4L
(3)A→B的反应类型是______________,D→E的目的是____________________________,F的化学名称为____________________________。
(4)写出F→G的化学方程式__________________________________________。
(5)某烃的含氧衍生物X符合下列条件的同分异构体有种______________ (不含立体异构)。
①氧原子数与B相同但相对分子质量比B少36
②能发生水解反应
其中核磁共振氢谱只有2组峰的是__________________________ (写结构简式)
(6)写出用苯酚、![]() 为原料(其他无机试剂任选)制备化合物
为原料(其他无机试剂任选)制备化合物![]() 的合成路线。____________________
的合成路线。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:
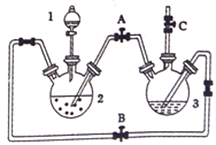
(1)稀硫酸应放在_____________(填写仪器名称)中。
(2)本实验通过关闭开关________、打开开关_________,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___________________。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___________
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
滴定过程中发生反应的离子方程式为______________。滴定终点的现象是__________________________。通过实验数据计算的该产品纯度为_____________(用字母a、b表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A. 4Fe(OH)2+2H2O+O2===4Fe(OH)3↓
B. 2Fe+2H2O+O2===2Fe(OH)2↓
C. 2H2O+O2+4e-===4OH-
D. Fe-3e-===Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色、澄清溶液中可能含有①Na+、②SO![]() 、③Cl-、④HCO3-、⑤CO
、③Cl-、④HCO3-、⑤CO![]() 、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
(1) | 用紫色石蕊试液检验 | 溶液变红 |
(2) | 向溶液中滴加BaCl2和稀HCl | 有白色沉淀生成 |
(3) | 将(2)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
下列结论正确的是
A.肯定含有的离子是②③⑥
B.该实验无法确定是否含有③
C.可能含有的离子是①③⑦
D.肯定没有的离子是④⑤,可能含有的离子是②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,回答有关问题:
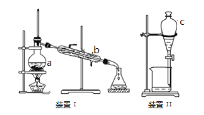
(1)写出装置I中有关仪器的名称:a ________________,b__________________,该装置分离混合物的原理是根据混合物各组分______________不同进行分离的。
(2)装置II中仪器C 的名称为_______________,使用C前必需进行的操作是 _______________为使C中液体顺利流下,打开活塞前应进行的操作是 _________________________。
(3)下面是用36.5%的浓盐酸(ρ=1.19g/cm3)配制250mL 0.5mol/L的稀盐酸 的操作,请按要求填空:
①配制上述溶液所需的玻璃仪器除玻璃棒、量筒、烧杯,还有 _____________________,需要量取浓盐酸的体积为 ____________mL。
②下列操作中,会造成所配溶液浓度偏低的是______(填字母)。
a.定容时,俯视刻度线 b.没有洗涤烧杯和玻璃棒
c.洗涤后的容量瓶中残留少量蒸馏水。d.量筒量取盐酸前没有用浓盐酸润洗。
③经测定,所配溶液的浓度偏小,如果忽略实验过程产生的误差,可能的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;其中E元素为原子半径最小的元素,且A、C同周期,B和C同主族;A与B可形成离子化合物A2B,其含有的离子具有相同的电子层结构,且电子总数为30;D和E可形成4核10电子分子,该分子可使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)C元素的元素符号为________;
(2)B、D元素的第一电离能大小关系为:B_____D(填“<”、“>”或“=”);
(3)写出D元素形成的单质的结构式为______________,其中σ键:π键=______。
(4)A2B对应的水化物的碱性比LiOH _______(填“强”或“弱”);化合物A2B2属于_______(选“离子”或“共价”)化合物,写出A2B2的电子式_________________,A2B2溶于水时发生反应的化学方程式为__________________________________________________
(5)化合物E2B、E2C,它们结构与组成相似,热稳定性更强的是__________(填化学式)
但E2B的沸点比E2C高得多的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 气体单质中,一定有σ键,可能有π键 B. σ键比π键重叠程度大,形成的共价键强
C. 两个原子间形成共价键时,最多有一个σ键 D. N2分子有一个σ键,两个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是
A. 常温常压下,1.8g甲基(—CD3)中含有的中子数为NA
B. 标准状况下,11.2L乙烯和环丙烷(C3H6)的混合气体中,共用电子对的数目为3NA
C. 过量铜与含0.4 mol HNO3的浓硝酸反应,电子转移数大于0.2NA
D. 常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com