
【题目】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:
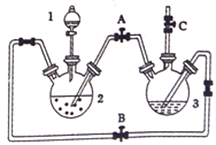
(1)稀硫酸应放在_____________(填写仪器名称)中。
(2)本实验通过关闭开关________、打开开关_________,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___________________。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___________
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
滴定过程中发生反应的离子方程式为______________。滴定终点的现象是__________________________。通过实验数据计算的该产品纯度为_____________(用字母a、b表示)。
【答案】 分液漏斗 A bc 防止生成的氢氧化亚铁被氧化 d MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O 滴入最后一滴酸性高锰酸钾溶液,溶液变为浅红色,且30s不变色 980b/a×100%
【解析】(1)此实验目的是制备氢氧化亚铁,先用铁和稀硫酸反应制备硫酸亚铁,此反应在装置2中进行,稀硫酸是溶液,应盛放在分液漏斗中,即应盛放在1处D的分液漏斗中,正确答案:分液漏斗。
(2)打开BC,关闭A,利用装置2中产生的氢气,把装置3中的空气排尽,使装置处于还原氛围,然后关闭B,打开A,产生气体压强增大,把产生的FeSO4压入到装置3中,产生白色沉淀Fe(OH)2,氢氧化亚铁溶液被空气中的氧气所氧化,生成氢氧化铁,对氢氧化亚铁颜色的观察产生干扰,所以要排除装置中的空气,防止生成的氢氧化亚铁被氧化,正确答案: A ;BC ;防止生成的氢氧化亚铁被氧化。
(3)①因为硫酸亚铁铵易溶于水,不溶于乙醇,应该用乙醇洗涤,减少硫酸亚铁铵的溶解,同时利用乙醇和水互溶,用90%的乙醇溶液洗涤,从而达到洗涤的要求,正确答案是:d。
②利用高锰酸钾的强氧化性,Fe2+的强还原性,两者发生氧化还原反应, Fe2+被氧化成Fe3+化合价升高1,Mn由+7价→+2价,降低5,最小公倍数5,根据原子守恒、电荷守恒,反应的方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;向溶液中滴加中高锰酸钾溶液,溶液无色,因此随着最后一滴高锰酸钾溶液的滴入,溶液由无色变为浅紫色,且30s不变色,达到反应终点;因为第三次与第一次、第二次相差较大,忽略不计,消耗高锰酸钾溶液的体积为(20.2+19.98)/2=20mL,根据离子反应方程式得出:n((NH4)2SO4·FeSO4·6H2O)=5n(KMnO4)=20×10-3×b×5=0.1b mol,则500mL溶液中含有NH4)2SO4·FeSO4·6H2O 的量为500/20×0.1b=2.5 b mol,所以该晶体的纯度为2.5 b×392/a×100%=980 b/a×100%;正确答案:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O ;滴入最后一滴酸性高锰酸钾溶液,溶液变为浅红色,且30s不变色 ;980b/a×100%。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列有关蒸馏的说法不正确的是
A.能将粗盐提纯B.能将四氯化碳和溴进行分离
C.操作时需加入几块沸石,以防暴沸D.部分蒸馏需要使用温度计便于控制温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知PbS、CuS、HgS的溶度积分别为9.0×10-29、1.3×10-36、4×10-53。下列说法正确的是
A. 硫化钠可作处理废水中含上述金属离子的沉淀剂
B. 在硫化铜悬浊液中滴几滴硝酸铅溶液,会生成硫化铅
C. 在含Pb2+、Cu2+、Hg2+的溶液中滴加硫化钠溶液,当溶液中c(S2-)=0.001mol/L时三种金属离子不能都完全沉淀
D. 向含Pb2+、Cu2+、Hg2+的浓度均为0.010mol/L的溶液中通入硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玫瑰的香味物质中包含蚽烯,蚽烯的键线式为:![]() 。
。
(1)1 mol蚽烯最多可以跟____ mol H2发生反应。
(2)写出蚽烯跟等物质的量的Br2发生加成反应所得产物的可能的结构_______________ (用键线式表示)。
(3)有机物A是蚽烯的同分异构体,分子中含有“![]() ”结构,A可能的结构为______(用键线式表示)。
”结构,A可能的结构为______(用键线式表示)。
(4)写出![]() 与Cl2发生1,4-加成反应的化学方程式____________。
与Cl2发生1,4-加成反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇缩甲醛有热塑性,耐磨,可以制造高强度漆包线。由A制备聚乙烯醇缩甲醛等的合成路线(部分反应条件略去)如下所示:
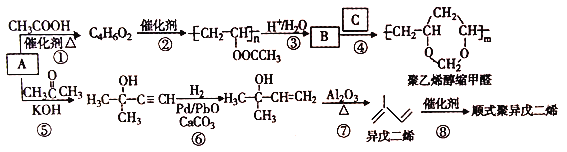
回答下列问题:
(1)A的结构简式是________,B含有的官能团名称是________;①的反应类型是______,⑦的反应类型是_________。
(2)B和C的结构简式分别为_______、_______。
(3)异戊二烯分子中最多有_____个原子共平面,顺式聚异戊二烯的结构简式为_______;写出与A具有相同官能团的异成二烯的所有同分异构体_______ (填结构简式)。
(4)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl﹣、SO42-和NO3﹣的相互分离。相应的实验过程可用下图表示:
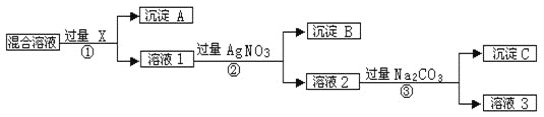
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___________,沉淀C______________。
(2)按此实验方案得到的溶液3中肯定含有杂质;为了解决这个问题,可以向溶液3中加入适量的____________。
(3)上述实验流程中加入过量的AgNO3,确认AgNO3已过量的实验方法是________________________。
(4)写出步骤①中发生反应的离子方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石英晶体的平面示意图如图所示,它实际上是网状结构,其中硅、氧原子的个数比是m:n,有关叙述正确的是( )(相对原子量Si 28 O 16)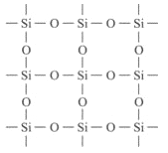
A. 6g该晶体中含有0.1NA个分子
B. m:n=2:1
C. 原硅酸根SiO44—的结构为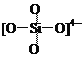 ,则二聚硅酸根离子Si2O7x—中的x=6
,则二聚硅酸根离子Si2O7x—中的x=6
D. 六聚硅酸根[Si6O18]y—中的y=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3 + 5O2 = 4NO + 6H2O,若反应速率分别是ν(NH3)、ν(O2)、ν(NO)、ν(H2O气)(单位:molL-1min-1)。下列关系正确的是 ( )
A. 4/5ν(NH3)=ν(O2) B. 5/6ν(O2)=ν(H2O)
C. 2/3ν(NH3)=ν(H2O) D. 4/5ν(O2)=ν(NO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com