
【题目】已知PbS、CuS、HgS的溶度积分别为9.0×10-29、1.3×10-36、4×10-53。下列说法正确的是
A. 硫化钠可作处理废水中含上述金属离子的沉淀剂
B. 在硫化铜悬浊液中滴几滴硝酸铅溶液,会生成硫化铅
C. 在含Pb2+、Cu2+、Hg2+的溶液中滴加硫化钠溶液,当溶液中c(S2-)=0.001mol/L时三种金属离子不能都完全沉淀
D. 向含Pb2+、Cu2+、Hg2+的浓度均为0.010mol/L的溶液中通入硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS
【答案】A
【解析】CuS、PbS、HgS为相同类型的难溶物,可以直接根据它们的溶度积判断溶解度大小,由CuS、PbS、HgS的溶度积可以知道,溶解度由大到小的顺序为HgS、CuS、PbS。硫化钠能够与Pb2+、Cu2+、Hg2+离子反应生成难溶物CuS、PbS、HgS,所以硫化钠是处理废水中含上述金属离子的沉淀剂,A正确;在硫化铜悬浊液中滴几滴硝酸铅溶液,因为硫化铜的溶度积小于硫化铅,所以硫化铜不能转化硫化铅,B错误; 在含Pb2+、Cu2+、Hg2+的溶液中滴加硫化钠溶液,当![]() 时,各离子浓度分别为c(Hg2+)=6.4×10-20mol/L、c(Cu2+)=1.3×10-33mol/L、c(Pb2+)=9×10-26mol/L,三种金属离子浓度都小于
时,各离子浓度分别为c(Hg2+)=6.4×10-20mol/L、c(Cu2+)=1.3×10-33mol/L、c(Pb2+)=9×10-26mol/L,三种金属离子浓度都小于![]() ,所以
,所以![]() 、
、![]() 、
、![]() 离子都完全沉淀,C错误;CuS、PbS、HgS为相同类型的难溶物,可通过它们的溶度积直接判断溶解度大小,根据题干信息可以知道,溶解度最小的、最难溶的为HgS,溶度积最大、最后生成沉淀的为PbS,所以产生沉淀的顺序依次为HgS、 CuS、PbS,D错误;正确选项A。
离子都完全沉淀,C错误;CuS、PbS、HgS为相同类型的难溶物,可通过它们的溶度积直接判断溶解度大小,根据题干信息可以知道,溶解度最小的、最难溶的为HgS,溶度积最大、最后生成沉淀的为PbS,所以产生沉淀的顺序依次为HgS、 CuS、PbS,D错误;正确选项A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A.BF3是三角锥形分子
B.NH![]() 的电子式:
的电子式: ,离子呈平面形结构
,离子呈平面形结构
C.CH4分子中的4个C﹣H键都是氢原子的1s轨道与碳原子的p轨道形成的s﹣p σ键
D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s﹣sp3σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G的一种合成路线如下:

已知:①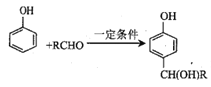 ;
;
②D溶液显酸性
③浓硫酸能与酚类物质发生取代反应,在苯环上引入-SO2H
回答下列问题:
(1)E分子中的含氧官能团名称为____________________________。
(2)下列关于化合物B的说法不正确的是______________ (填标号)。
①苯环上一氯代物有2种
②分子式为C8H10O2
③既能与FeCl3溶液发生显色反应又能与溴水发生加成反应
④1mol化合物B与足量金属钠反应生成标准状况下氢气22.4L
(3)A→B的反应类型是______________,D→E的目的是____________________________,F的化学名称为____________________________。
(4)写出F→G的化学方程式__________________________________________。
(5)某烃的含氧衍生物X符合下列条件的同分异构体有种______________ (不含立体异构)。
①氧原子数与B相同但相对分子质量比B少36
②能发生水解反应
其中核磁共振氢谱只有2组峰的是__________________________ (写结构简式)
(6)写出用苯酚、![]() 为原料(其他无机试剂任选)制备化合物
为原料(其他无机试剂任选)制备化合物![]() 的合成路线。____________________
的合成路线。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A. 该反应是吸热反应
B. 该反应是放热反应
C. 铁粉和硫粉在常温下可以发生反应
D. 硫化亚铁的总能量高于铁粉和硫粉的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化亚铁易被氧化,制取过程要隔绝空气。现用铁屑、稀硫酸、氢氧化钠溶液制备氢氧化亚铁并观察其颜色,改进装置如下:
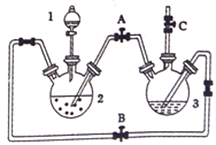
(1)稀硫酸应放在_____________(填写仪器名称)中。
(2)本实验通过关闭开关________、打开开关_________,将仪器中的空气排尽后,后续实验就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___________________。
(3)在FeSO4溶液中加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___________
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用30%的乙醇溶液洗 d.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液。每次取待测液20.00mL,用浓度为bmol/L的酸性KMnO4溶液滴定,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗酸性高锰酸钾溶液体积/mL | 20.02 | 19.98 | 20.52 |
滴定过程中发生反应的离子方程式为______________。滴定终点的现象是__________________________。通过实验数据计算的该产品纯度为_____________(用字母a、b表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种短周期元素的原子序数的大小顺序为C>A>B>D>E;其中E元素为原子半径最小的元素,且A、C同周期,B和C同主族;A与B可形成离子化合物A2B,其含有的离子具有相同的电子层结构,且电子总数为30;D和E可形成4核10电子分子,该分子可使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)C元素的元素符号为________;
(2)B、D元素的第一电离能大小关系为:B_____D(填“<”、“>”或“=”);
(3)写出D元素形成的单质的结构式为______________,其中σ键:π键=______。
(4)A2B对应的水化物的碱性比LiOH _______(填“强”或“弱”);化合物A2B2属于_______(选“离子”或“共价”)化合物,写出A2B2的电子式_________________,A2B2溶于水时发生反应的化学方程式为__________________________________________________
(5)化合物E2B、E2C,它们结构与组成相似,热稳定性更强的是__________(填化学式)
但E2B的沸点比E2C高得多的原因是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com