
【题目】下列几种酸中,酸性最弱的是
A.HClO4B.HIC.H3PO4D.H2CO3
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3 ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:
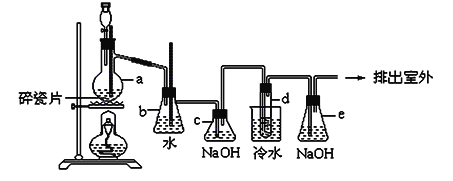
(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易产生副反应。请你写出乙醇的这个消去反应方程式:___。
(2)写出制备1,2-二溴乙烷的化学方程式________。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象__________。
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(写出一条)___。
(5)c装置内NaOH溶液的作用___________;写出e装置内NaOH溶液中所发生的化学反应方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
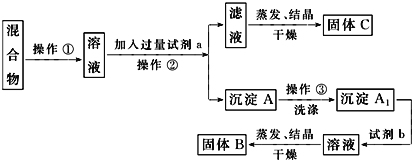
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
(1)试剂a是_________,加入试剂b所发生反应的离子方程式为_________。
(2)该方案能否达到实验目的_____(填“能”或“不能”)。若不能,应如何改进?_____(若能,此问不用回答)。
(3)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外至少还要获得的数据是____的质量。
(4)用所(3)所制备的KCl固体配制0.1mol/LKCl溶液450mL,回答下列问题:
(i)配制过程中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、____________。
(ii)需要用托盘天平称量______________gKCl固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.若要完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3的体积比为1:1:1,则原NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为
A. 1:1:1 B. 1:2:3 C. 6:3:2 D. 9:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,向氨水溶液中通入CO2,各种离子的变化趋势如下图所示。下列说法正确的是
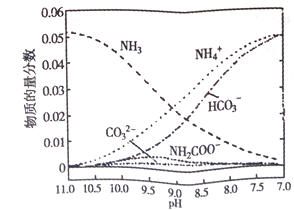
A. 随着CO2的通入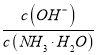 不断增大
不断增大
B. 在pH=9.0时,c(NH4+)>c(CO32-)><(HCO3-)>c(NH2CO0O-)
C. 溶液中: c(NH4+)+c(NH3)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
D. 在溶液中pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知PbS、CuS、HgS的溶度积分别为9.0×10-29、1.3×10-36、4×10-53。下列说法正确的是
A. 硫化钠可作处理废水中含上述金属离子的沉淀剂
B. 在硫化铜悬浊液中滴几滴硝酸铅溶液,会生成硫化铅
C. 在含Pb2+、Cu2+、Hg2+的溶液中滴加硫化钠溶液,当溶液中c(S2-)=0.001mol/L时三种金属离子不能都完全沉淀
D. 向含Pb2+、Cu2+、Hg2+的浓度均为0.010mol/L的溶液中通入硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有FeCl2、FeCl3、CuCl2、Cu
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
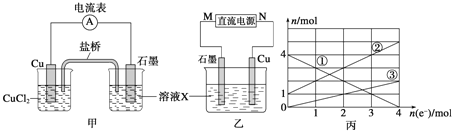
①图中X溶液是______________________;
②Cu电极上发生的电极反应式为_________________;
③原电池工作时,盐桥中的_______________离子(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是___________极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入_________L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示.该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向_____________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________________。

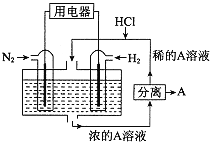
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________________________,A是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玫瑰的香味物质中包含蚽烯,蚽烯的键线式为:![]() 。
。
(1)1 mol蚽烯最多可以跟____ mol H2发生反应。
(2)写出蚽烯跟等物质的量的Br2发生加成反应所得产物的可能的结构_______________ (用键线式表示)。
(3)有机物A是蚽烯的同分异构体,分子中含有“![]() ”结构,A可能的结构为______(用键线式表示)。
”结构,A可能的结构为______(用键线式表示)。
(4)写出![]() 与Cl2发生1,4-加成反应的化学方程式____________。
与Cl2发生1,4-加成反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向浓度均为0.10mol/L、体积均为1mL的NaOH溶液和Na2CO3溶液中分别加水,均稀释至VmL,两种溶液的pH与lgV的变化关系如图所示。下列叙述中错误的是
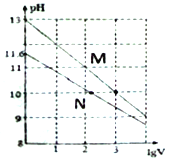
A. Ka1(CO32-)(Ka1为第一级水解平衡常数)的数量级为10-4
B. 曲线N表示Na2CO3溶液的pH随lgV的变化关系
C. Na2CO3溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
D. 若将Na2CO3溶液加热蒸干,由于CO32-水解,最终析出的是NaOH固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com