
【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一.
(1)焦炭与水蒸气反应是将固体煤变为气体燃料的方法.已知:
①C(s)+O2 (g)=CO2 (g)△H=﹣393.5kJmol﹣1
②CO(g)+ ![]() O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
O2 (g)=CO2 (g)△H=﹣283.0kJmol﹣1
③H2(g)+ ![]() O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
O2 (g)=H2O (g)△H=﹣241.8kJmol﹣1
则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是 , 该反应的化学平衡常数K随温度的升高将(填“增大”、“减小”或“不变”).
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)CO2(g)+H2(g)△H<0.在甲、乙两个恒容密闭容器中,起始时按照表数据进行投料,在800℃时达到平衡状态,K=1.0.
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为 .
(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2 , 负极通入CO,电解质是熔融碳酸钠,写出工作时正极的电极反应式: , 若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为(标准状况下)L.
(4)将(2)中生成的混合气用过量的NaOH溶液吸收,得到的溶液中有一种溶质可以水解,请写出其水解的离子方程式: , .
【答案】
(1)C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;增大
(2)逆反应;50%
(3)O2+4e﹣+2CO2=2CO32﹣;6.72
(4)CO32﹣+H2O?HCO3﹣+OH﹣;HCO3﹣+H2O?H2CO3+OH﹣
【解析】解:(1)在25℃、101kPa时,H2与O2化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为:H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8 kJ/mol,
O2(g)═H2O(g)△H=﹣241.8 kJ/mol,
已知:①C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
②CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJ/mol
O2(g)═CO2(g)△H=﹣283.0kJ/mol
③H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8 kJ/mol,
O2(g)═H2O(g)△H=﹣241.8 kJ/mol,
根据盖斯定律,①﹣③﹣②得C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJmol﹣1 , 由于该反应为吸热反应,所以升高温度平衡正移,K增大;
所以答案是:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ/mol;增大;(2)甲容器中:Qc= ![]() =
= ![]() =
= ![]() >1=K,所以反应向逆反应进行;
>1=K,所以反应向逆反应进行;
令参加反应的CO的物质的量为nmol,则:
CO(g)+ | H2O(g) | CO2(g)+ | H2(g) | ||
开始(mol): | 0.1 | 0.1 | 0 | 0 | |
变化(mol): | n | n | n | n | |
平衡(mol): | 0.1-n | 0.1-n | n | n |
由于反应前后气体的体积不变,可以用物质的量代替浓度计算平衡常数,故 ![]() =1,解得n=0.05,故CO的转化率为
=1,解得n=0.05,故CO的转化率为 ![]() ×100%=50%,
×100%=50%,
所以答案是:逆反应;50%;(3)以CO为燃料制作燃料电池,电池的正极通入O2和CO2 , 负极通入CO,电解质是熔融碳酸盐,依据原电池反应原理可知负极是一氧化碳失电子发生氧化反应生成二氧化碳的过程,正极上氧气得到电子被还原,与二氧化碳反应生成CO32﹣ , 电极方程式为:O2+4e﹣+2CO2=2 CO32﹣;
若使用该电池电解熔融Al2O3制取10.8g Al,结合电解反应化学方程式计算,2Al2O3 ![]() 4Al+3O2↑;n(Al)=
4Al+3O2↑;n(Al)= ![]() =0.4mol
=0.4mol
依据电子守恒得到:O2~4e﹣~ ![]() Al,
Al,
则理论上需要氧气物质的量为0.3mol,氧气的体积为(标准状况下) 6.72L,
所以答案是:O2+4e﹣+2CO2=2 CO32﹣;6.72(4)因(2)中生成的混合气含有CO2 , 用过量的NaOH溶液吸收生成Na2CO3 , 为强碱弱酸盐,水解呈碱性,离子方程式为CO32﹣+H2OHCO3﹣+OH﹣ , HCO3﹣+H2OH2CO3+OH﹣ ,
所以答案是:CO32﹣+H2OHCO3﹣+OH﹣、HCO3﹣+H
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海带、海藻中丰富的碘元素主要以碘化钾的形式存在.化学小组欲用海带制取少量碘单质,先将海带烧成灰,再用水浸泡一段时间(让碘化物充分溶解),得到海带灰悬浊液,然后按以下流程提取单质碘(已知:2I﹣+Cl2=2Cl﹣+I2).
(1)过程 ①中使用的玻璃仪器;
(2)过程②中充入适量Cl2的目的是;
(3)提取碘的过程中实验操作③的名称: , 选择的有机试剂可以是(填序号);
A.酒精 B.四氯化碳 C.醋酸 D.苯
(4)过程③中有以下操作.
①倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,放正分液漏斗;
②把50mL碘水和15mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
③将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
④把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层;
⑤从分液漏斗上口倒出上层液体.
⑥旋开分液漏斗下面的活塞,用烧杯接收下层液体;
⑦检验分液漏斗活塞和上口的玻璃塞是否漏液;
操作顺序正确的是(填字母).
A.⑦①②③④⑤⑥
B.⑦②①④③⑥⑤
C.⑦①②④③⑥⑤
D.⑦②①③④⑥⑤
(5)过程 ④从含碘的有机溶液中提取碘并回收有机溶剂,还需要经过蒸馏、冷凝(如图).则冷水的流向为 . 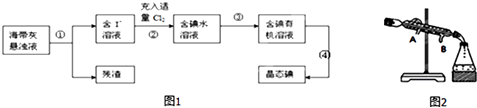
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于胶体和溶液的叙述中正确的是( )
A.胶体能透过半透膜,而溶液不能
B.胶体加入某些盐可产生沉淀,而溶液不能
C.胶体粒子直径比溶液中离子直径大
D.胶体能够发生丁达尔现象,溶液也能发生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )![]()
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到下图,则曲线a所对应的实验组别是( ) 
组别 | c(HCl)(molL﹣1) | 温度(℃) | 状态 |
A | 2.0 | 25 | 块状 |
B | 2.5 | 30 | 块状 |
C | 2.5 | 50 | 粉末状 |
D | 2.5 | 50 | 块状 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1molCl2参加反应转移电子数不一定为2NA
B.在16g18O2中含有10NA个中子
C.标准状况下,22.4L HF中含2NA个原子
D.3mol单质Fe完全转变为Fe3O4 , 失去9NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com