

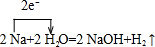 ,
,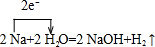 ;
;

科目:高中化学 来源: 题型:

| 物质 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 293K溶解度(g) | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出).回答下列问题:
印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
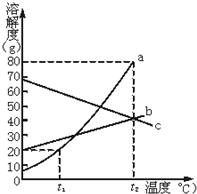 根据溶解度曲线回答问题.
根据溶解度曲线回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在C60和K3C60中,碳元素分别以游离态和化合态存在 |
| B、C60是一种含碳化合物 |
| C、等质量的C60和金刚石含碳原子数目相同 |
| D、C60与石墨互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com