
【题目】巴伊亚祖母绿号称是世界上最大的祖母绿矿石,重380余公斤,含有约18万克拉的祖母绿宝石,价值约4亿美元。祖母绿的元素组成是O、Si、Al、Be,化学式为Be3Al2Si6O18 。
(1)基态Al原子中,电子占据的最高能级的符号是 ,该能级具有的原子轨道数为 。
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在(如图),在1000℃,氯化铍则以BeCl2形式存在。在BeCl2分子中,Be的杂化方式为 ,二聚体Be2Cl4中Be的杂化方式为 ,1mol Be2Cl4中含有 mol配位键。

(3)氢化铝锂(LiAlH4)是有机合成中的一种重要还原剂,可以将羧基还原为羟基,如可将乙酸还原为乙醇,乙酸和乙醇的熔沸点数据如下:
乙酸 | 乙醇 | |
熔点/℃ | 16.6 | -114.3 |
沸点/℃ | 117.9 | 78.4 |
乙酸分子中σ键与π键数目之比为 ,由表格中的数据知,乙酸的熔沸点均比乙醇高,原因是 。
(4)图示为Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度ρ=3.00g/cm3,则晶胞参数a= nm。

【答案】(1)3p,3(2)sp,sp2,2(3)7:1 乙酸中羧基上的两个氧原子均可形成氢键,比乙醇形成分子间氢键的概率大。(4)0.38
【解析】试题分析:(1)基态Al原子的质子数是13,核外电子排布式为1s22s2p63s23p1,所以电子占据的最高能级的符号是3p,该能级具有的原子轨道数为3个。
(2)BeCl2中Be原子的价层电子对个数=2+(2-2×1)/2=2,不含孤电子对,则分子空间构型是直线型,因此Be的杂化方式为sp杂化。在二聚体中Be原子形成3个B-Cl键,没有孤对电子,杂化轨道数目为3,Be原子杂化方式为sp2,根据结构式可判断1mol Be2Cl4中含有2mol配位键;
(3)单键都是σ键,双键中含有1个σ键和1个π键,则根据乙酸的结构简式CH3COOOH可知乙酸分子中σ键与π键数目之比为7:1;由于乙酸中羧基上的两个氧原子均可形成氢键,比乙醇形成分子间氢键的概率大,因此乙酸的熔沸点均比乙醇高。
(4)根据晶胞结构可知该晶胞中含有的阴阳离子个数均是4个,所以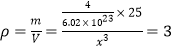 ,解得x=0.38×10-7cm=0.38nm。
,解得x=0.38×10-7cm=0.38nm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向盛有Cl2的六个集气瓶甲、乙、丙、丁、戊、己中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙、丁、戊、己注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水 ④淀粉-KI溶液 ⑤FeCl2与KSCN混合液 ⑥NaBr溶液

A.④①②⑥⑤③ B.⑥①③④②⑤ C.⑥③②④①⑤ D.②①③④⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:A ;
(2)写出步骤②中发生反应的离子方程式 。
(3)D溶液中滴入石蕊试液,现象是 ,原因是 (用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“群众利益无小事,食品安全是大事”。下列作法不会导致食品对人体健康有害的是
A. 用甲醛浸泡易腐烂的食品
B. 用硫磺熏制白木耳、粉丝等食品
C. 用干冰保藏易变质的食品
D. 用含亚硝酸钠的工业用盐腌制食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、氯及其化合物有如下转化关系,请按要求填空:

(1)金属钠的密度比水 ,实验室中金属钠通常保存在 中。一小块金属钠投入水中的反应方程式是 。
(2)Na2O2 是 色的固体,Na2O2 的重要用途是 ,有关反应的化学方程式为 。
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为 。
(4)漂白粉的有效成份是 (填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,物质①4 g H2 ,② 33.6L CH4 ,③1mol H2O ,④3.01×1023个O2.(填序号,下同)
(1)质量最大的是____ ___,(2)分子数最多的是_ __ __,
(3)原子数最少的是___ ____,(4)体积最小的是_ __ ____.
(5)电子数最多的是___ ____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2+4HCI(浓) ![]() MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O
取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为6.72L。
请回答下列问题:
(1)参加反应的二氧化锰的质量为 。
(2)参加反应的HCl的物质的量为 。
(3)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3, 为使用方便,请计算出该浓盐酸的物质的量浓度: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O![]() H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14.则下列叙述正确的是( )
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14,KW(35℃)=2.1×10-14.则下列叙述正确的是( )
A.c(H+)随温度的升高而降低 B.35℃时,c(H+)>c(OH-)
C.溶液:pH(35℃)>pH(25℃) D.35℃时已电离的水的浓度约为2×10-7mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com