
【题目】按分子结构决定性质的观点可推断  有如下性质:
有如下性质:
(1)苯环部分可发生反应和反应.
(2)﹣CH═CH2部分可发生反应和反应.
(3)该有机物滴入溴水后生成产物的结构简式为 .
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】R、Q、X、Y、Z是原子序数依次增大的五种短周期主族元素,R与Q形成的气态化合物的水化物显碱性,X、Y、Z三种元素族序数之和为10,Y单质能与强碱溶液反应,Z元素原子最外层电子数是电子层数的两倍。
(1)Z在周期表中的位置_______________;X、Y、Z三种元素形成的简单离子半径由大到小的顺序是________________________。(用离子符号回答)
(2)X和R两种元素按原子个数比1:1组成的化合物的电子式为____________。
(3)写出Y、Z两种元素最高价氧化物对应的水化物相反应的离子方程式:_____________。
(4)水的沸点远高于Z元素的氢化物的沸点,原因是_________________。
(5)Q4是一种Q元素的新单质,可用作推进剂或炸药,推算其分子中含有_____对共用电子。
(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子的结构式为_____________________。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z 形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是
A. X的最高价氧化物的水化物一定为强酸 B. 气态氢化物的沸点:Y<M
C. 原子半径Z>M>X>Y D. Z是地壳中含量最多的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1molL﹣1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是 .
②根据表中数据判断,浓度均为0.01molL﹣1的下列四种物质的溶液中,酸性最强的是;将各溶液分别稀释100倍,pH变化最小的是(填编号).
A.HCN B.HClO C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为 .
(2)已知常温下Cu(OH)2的Ksp=2×10﹣20 . 又知常温下某CuSO4溶液里c(Cu2+)=0.02molL﹣1 , 如果要生成Cu(OH)2沉淀,则应调整溶液pH大于;要使0.2molL﹣1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质的比较,不正确的是( )
A.原子半径大小:Na>P>S
B.非金属性强弱:I>Br>Cl
C.氧化性强弱:F2>Cl2>Br2
D.金属性强弱:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下的四种溶液:①pH=2的醋酸;②pH=a的Na2CO3溶液,体积为VL;③pH=2的硫酸;④pH=12的氢氧化钠溶液.下列有关说法正确的是( )
A.将②溶液用蒸馏水稀释,使体积扩大十倍,所得溶液pH变为a﹣1
B.V1L③和V2L④混合,若混合后溶液pH=3,则V1:V2=11:9
C.①与④等体积混合后,混合液pH=7
D.①与③两溶液的物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布图:_________,核外有_________种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
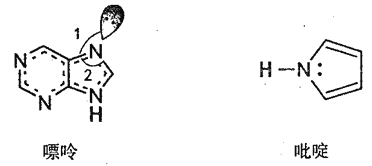
①嘌呤中所有元素的电负性由大到小的顺序__________。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因_____________。
③吡啶结构中N 原子的杂化方式___________。
④分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__________。
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__________。
(3)碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是______。
A.每个分子中孤对电子数不变 B.分子极性变化
C.原子间成键方式改变 D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率: 干冰___冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4 均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因______。
(4)在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是: 将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T- 碳的密度的表达式为______g/cm3。
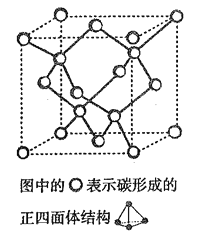
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com