
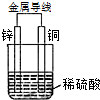
 图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| Date:2015.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Zn极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol. ⑥正极的电极反应式:Zn-2e-=Zn2+ |
分析 (1)Zn、Cu、稀硫酸构成原电池,锌易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,电子从负极沿导线流向正极,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;
(2)当锌片不纯时,在锌片上形成原电池;
(3)如果把锌片换成石墨,该装置不能自发进行氧化还原反应,所以不能构成原电池;
(4)如果把硫酸换成硫酸铜溶液,正极上析出Cu.
解答 解:(1)Zn、Cu、稀硫酸构成原电池,
①锌易失电子作负极、Cu作正极,故错误;
②氢离子向正极Cu移动,故错误;
③电子经外电路流动方向Zn→Cu,故正确;
④负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,Cu电极上生成氢气,故错误;
⑤若有1mol电子流过导线,则产生氢气的物质的量为0.5mol,故正确;
⑥正极反应式为2H++2e-=H2↑,故错误;
故答案为:③⑤;
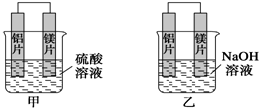
(2)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,是由于锌片不纯,在锌片上形成原电池导致,
故答案为:锌片不纯,在锌片上形成原电池;
(3)如果把锌片换成石墨,该装置不能自发进行氧化还原反应,所以不能构成原电池,所以没有电流产生,
故答案为:Cu和石墨都不与硫酸反应,不会形成原电池;
(4)如果把硫酸换成硫酸铜溶液,正极Cu上析出Cu,电极反应式为Cu2++2e-=Cu,
故答案为:铜极;Cu2++2e-=Cu.
点评 本题考查了原电池原理,明确原电池构成条件、正负极上发生的反应即可解答,知道电子流向、电解质溶液中阴阳离子流动方向,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 信息 | 问题 |
| ①短周期元素X、Y、Z、W,原子序数依次增大,最外层电子数均不少于最内层电子数 | (1)X一定不是AD A.氢 B.碳 C.氧 D.硫 |
| ②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中有铝元素吗?可能 |
| ③向上述四种元素的单质的混合物中,加入足量的盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中有白色沉淀 | (3)白色沉淀的化学式为Mg(OH)2 |
| ④向上述四种元素的单质的混合物中,加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中有白色沉淀 | (4)生成白色沉淀的离子方程式为SiO32-+2H+=H2SiO3↓(或SiO32-+2H++H2O=H4SiO4↓) |
| ⑤X与W同主族 | (5)X的最高价氧化物的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L氯气中含有的原子数为NA个 | |
| B. | 标准状况下1mol苯的体积是22.4L | |
| C. | 1mol金属钠和足量的氧气反应生成过氧化钠可转移的电子数为NA | |
| D. | 1L1mol/L的硫酸钾溶液中,硫酸根和钾离子总数为2 N A |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与新制的Cu(OH)2悬浊液反应 | B. | 能发生加聚反应生成高分子化合物 | ||
| C. | 能与新制银氨溶液发生银镜反应 | D. | 与钠反应放出氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com