
| A. | 将试剂瓶中的Na2CO3溶液倒入试管,发现取量过多,将过量的试剂倒回试剂瓶中 | |
| B. | 将含有Ba(NO3)2的废液倒入指定的容器中回收 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,立刻转移到容量瓶中 |
分析 A.一些易变质的药品在使用时一般不能放回原试剂瓶;
B.Ba(NO3)2属于重金属盐,是有毒物质;
C.蒸发时不能将溶液蒸干;
D.容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体.
解答 解:A.Na2CO3易吸收空气中二氧化碳而变质,为防止试剂污染,不能放回原试剂瓶,故A错误;
B.Ba(NO3)2属于重金属盐,是有毒物质,不可以倒入水槽中再冲入下水道,故B正确;
C.蒸发时不能将溶液蒸干,应当有大量晶体析出时,停止加热,用余热蒸干,故C错误;
D.容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,浓硫酸溶于水放热,应冷却后在转移到容量瓶中,故D错误.
故选B
点评 本题考查化学实验基本操作知识,题目难度不大,本题注意常见基础知识的积累,把握化学基本操作方法.


科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
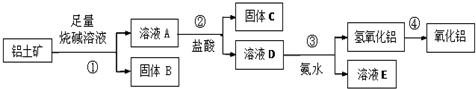
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 |
| (1) | NO | NO2 | ||
| (2) | Fe粉 | Al粉 | ||
| (3) | 氯化钠固体 | 氯化铵固体 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据元素周期表中第四周期元素的相关知识,回答下列问题:
根据元素周期表中第四周期元素的相关知识,回答下列问题: ,CNO-的中心原子的杂化方式为sp.
,CNO-的中心原子的杂化方式为sp.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ NH4+ SCN- Cl- | B. | Fe3+ Fe2+ Na+ NO3- | ||
| C. | Ba2+ H+ NO3- SO42- | D. | S2- Na+ ClO- OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com