
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100 mL-1)。
Ⅰ.实验步骤
(1)配制待测白醋溶液,用____(填仪器名称)量取10.00 mL食用白醋,在____(填仪器名称)中用水稀释后转移到100 mL____(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴____作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。
(4)滴定。判断滴定终点的现象是____,达到滴定终点,停止滴定,并记录NaOH溶液的最终读数,重复滴定3~4次。
(5)如图是某次滴定时的滴定管中的液面,其读数为____mL。
![]()
Ⅱ.实验记录
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
(6)按正确数据处理,得出c(市售白醋)=____mol/L,市售白醋总酸量=____g·100 mL-1。
【答案】酸式滴定管 烧杯 容量瓶 酚酞 溶液由无色变为浅红色,且半分钟内不褪色 22.60 0.75 4.5
【解析】
(1)准确量取一定体积的液体要使用滴定管,根据溶液酸碱性判断使用的滴定管的类型,根据配制物质的量浓度的溶液操作分析判断使用的仪器;
(2)根据酸、碱恰好中和时产生盐的酸碱性判断使用哪种指示剂;
(4)根据酚酞的变色范围为8.2~10.0,结合溶液的酸碱性判断滴定终点溶液的颜色变化;
(5)根据滴定管的结构:滴定管小刻度在上,大刻度在下,结合其精确度判断溶液的体积读数;
(6)去掉不合理实验数据,计算平均消耗的NaOH溶液的体积,根据二者恰好中和时n(CH3COOH)=n(NaOH),利用c=![]() 计算醋酸的浓度及市售白醋总酸量。
计算醋酸的浓度及市售白醋总酸量。
(1)白醋溶液显酸性,准确量取10.00 mL食用白醋要使用酸式滴定管;将量取的白醋在烧杯中进行稀释,然后将稀释后的溶液转移至100 mL的容量瓶中进行定容、摇匀,即得待测白醋溶液;
(2)NaOH与醋酸恰好中和产生CH3COONa是强碱弱酸盐,水解使溶液显碱性,所以要使用碱性范围内变色的酚酞为指示剂,可以减小滴定误差,故使用的指示剂为酚酞;
(4)白醋溶液显酸性,使酚酞试液显无色,随着NaOH的滴入,溶液酸性逐渐减弱,碱性逐渐增强,当滴加最后一滴NaOH溶液时,溶液由无色变为浅红色,且半分钟内不褪色,说明滴定达到终点,此时应停止滴加NaOH溶液;
(5)由滴定管凹液面所在位置,结合滴定管精确度为0.01 mL,可知该溶液的液面读数为22.60 mL;
(6)根据表格中四次实验结果数值可知:第一次实验数据偏差较大,要舍去,20.00 mL稀释的醋酸溶液反应消耗NaOH溶液的平均体积为V(NaOH)=![]() mL=15.00 mL,根据CH3COOH+NaOH=CH3COONa+H2O可知n(CH3COOH)=n(NaOH),所以稀释后的醋酸溶液的浓度c(CH3COOH)=
mL=15.00 mL,根据CH3COOH+NaOH=CH3COONa+H2O可知n(CH3COOH)=n(NaOH),所以稀释后的醋酸溶液的浓度c(CH3COOH)=![]() =0.075 mol/L,由实验操作可知:是将10.00 mL白醋稀释至100 mL,由于在稀释过程中溶质的物质的量不变,溶液的体积是原食醋的10倍,则稀释后溶液浓度为原食醋浓度的
=0.075 mol/L,由实验操作可知:是将10.00 mL白醋稀释至100 mL,由于在稀释过程中溶质的物质的量不变,溶液的体积是原食醋的10倍,则稀释后溶液浓度为原食醋浓度的![]() ,故该市售食醋的物质的量浓度c(市售白醋)=10×0.075 mol/L =0.75 mol/L。在100 mL该食醋中含有醋酸的物质的量为n(CH3COOH)=c·V=0.75 mol/L×0.1 L=0.075 mol,其质量为m(CH3COOH)=0.075 mol×60 g/mol=4.5 g,即市售白醋总酸量=4.5 g·100 mL-1。
,故该市售食醋的物质的量浓度c(市售白醋)=10×0.075 mol/L =0.75 mol/L。在100 mL该食醋中含有醋酸的物质的量为n(CH3COOH)=c·V=0.75 mol/L×0.1 L=0.075 mol,其质量为m(CH3COOH)=0.075 mol×60 g/mol=4.5 g,即市售白醋总酸量=4.5 g·100 mL-1。


科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:

下列有关判断不正确的是
A.甲的分子式为 C6H12
B.乙与环己二烯互为同系物
C.上述流程发生的反应类型有取代反应、消去反应、加成反应
D.环己二烯与溴水 1:1 反应可得 2 种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26届会议修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),于2019年5月2日正式生效。设NA是阿伏加德罗常数的值,下列说法正确的是
A.40g正丁烷和18 g异丁烷的混合物中共价键数目为13NA
B.常温常压下,124 g P4中所含P—P键数目为4NA
C.电解精炼铜时,阳极质量减小3.2g时,转移的电子数为0.1NA
D.0.1mol FeCl3完全水解转化为氢氧化铁胶体,生成胶粒数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素形成的单质在环境、生命活动、生产、科研等方面有重要作用。
(1)氟利昂在紫外线的作用下能产生氯原子,氯原子对臭氧层有破坏作用。氯原子对臭氧层的破坏作用可用如下过程表示:Cl+O3![]() ClO+O2、O3
ClO+O2、O3![]() O2+O、ClO+O
O2+O、ClO+O![]() Cl+O2。这一过程总的化学方程式是______________________________。根据总反应的化学方程式,可知氯原子在反应中作________________________。
Cl+O2。这一过程总的化学方程式是______________________________。根据总反应的化学方程式,可知氯原子在反应中作________________________。
(2)意大利科学家使用普通氧分子和带正电的氧离子制出了新型的氧分子O4,它可能具有与S4相似的长方形结构。O4的摩尔质量为______;相同质量的O2、O3、O4的分子数之比为______,原子数之比为______;下列有关O4的说法不正确的是______(填序号)。
A.题述中生成O4的反应不属于化学变化
B.O4与O2、O3都是氧的同素异形体
C.O2可能具有很强的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2通入BaCl2溶液无明显现象。某同学利用如图装置探究SO2与BaCl2溶液反应生成白色沉淀的条件。下列判断正确的是
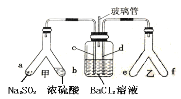
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.乙中产生的一定为氧化性气体,将BaSO3氧化为BaSO4沉淀
C.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
D.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是
①钴不是主族元素;②![]() Cl2不能长期稳定地存在;③Mg的原子结构示意图为
Cl2不能长期稳定地存在;③Mg的原子结构示意图为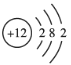 ;④鸟粪石中两种阳离子为Mg2+、NH4+
;④鸟粪石中两种阳离子为Mg2+、NH4+
A.①②③④B.仅①②④C.仅②③④D.仅①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是( )
)。下列说法错误的是( )
A.肉桂醛和苯甲醛都能发生加成反应、取代反应
B.可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C.肉桂醛和苯甲醛互为同系物
D.苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。甲醇的合成方法是:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列问题:
(1)甲醇的燃烧热为__kJ·mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为__。
(3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是(_________)
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
浓度/mol·L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
0 | 0.8 | 1.6 | 0 |
2 | 0.6 | x | 0.2 |
4 | 0.3 | 0.6 | 0.5 |
6 | 0.3 | 0.6 | 0.5 |
①x=__。
②前2min内H2的平均反应速率为v(H2)=__。该温度下,反应(ⅰ)的平衡常数K=__。(保留1位小数)
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是(_________)
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:
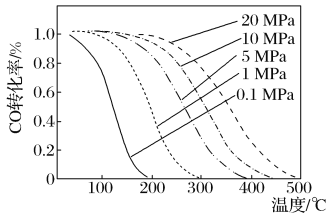
由图像可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,其原子序数依次增大,在元素周期表中,A的原子半径最小,B的族序数是其所在周期序数的2倍,D是地壳中含量最多的元素,在元素周期表中A和E同主族。试回答下列问题:
(1)化合物![]() 的电子式为______。
的电子式为______。
(2)化合物![]() 的电子式为______。
的电子式为______。
(3)C的简单氢化物与C的最高价氧化物对应水化物反应生成的盐的化学式为______。
(4)将物质的量之比为1:1的![]() 和
和![]() 组成的混合气体通入到a mol的过量固体
组成的混合气体通入到a mol的过量固体![]() 中,将反应后的固体混合物加入到500 mL 1 mol/L的盐酸中,产生无色混合气体的体积为b L(标准状况下),反应后溶液呈中性,则a=______,b=______。
中,将反应后的固体混合物加入到500 mL 1 mol/L的盐酸中,产生无色混合气体的体积为b L(标准状况下),反应后溶液呈中性,则a=______,b=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com