
����Ŀ���ҹ��Ƽҵ������������°�������1939�귢���������ĺ����Ƽ������ķ�Ӧԭ���������»�ѧ����ʽ��ʾ��NH3+C02+NaCl+H20��NH4CI+NaHCO3(����),���ݴ�ԭ�������Ƶ�̼�����ƾ��壬ijУѧ�����������ʵ��װ�ã�����Bװ���е��Թ��������а����Ȼ��Ƶ���Һ���Ҷ��߾��Ѵﵽ���͡�
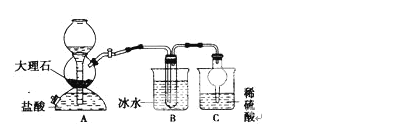
(1)Aװ������������Ӧ�����ӷ���ʽΪ____ Cװ�õ�����Ϊ___
(2)�±������г�������������ڲ�ͬ�¶��µ��ܽ������(g��100 gˮ)��
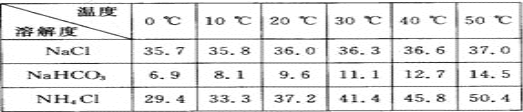
���ձ������ݣ������Bװ����ʹ�ñ�ˮ��Ŀ����__________________________
(3)��Уѧ���ڼ�������װ�õ������Ժ����ʵ�飬���û�еõ�̼�����ƾ��壬ָ����ʦָ��Ӧ��_______װ��֮��(��д��ĸ)����һ��ʢ��________��ϴ��װ�ã�������_______________��
(4)����Уѧ������ʵ��ʱ�����ñ���ʳ��ˮ�к�NaCl������Ϊ5��85 g��ʵ���õ������NaHCO3���������Ϊ5��04 g����NaHCO3�IJ���Ϊ____________________��
���𰸡�CaCO3+2H+��Ca2++CO2��+H2O �����������չ�����������Ⱦ �¶�Խ��̼�������ܽ��ԽС���������� AB ����̼��������Һ ��ȥ������̼�����е��Ȼ������� 60%
��������
(1)Aװ����ָȡ������̼�����װ�ã���̼��ƺ����ᷢ����Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼��Cװ��ϡ������β������װ�����չ����İ�����
(2)Bװ���е��Թ��������а����Ȼ��Ƶı�����Һ��ͨ�������̼����ᷢ����Ӧ����̼�����ƺ��Ȼ�泥��¶�Խ��Խ������̼�����Ƶľ���������
(3)ͨ�������̼û�еõ�̼�����ƾ��壬�Ƕ�����̼�����к����Ȼ������壬ͨ���Ͱ�����Ӧ��������̼�����ƣ�������Ҫ��һ��ϴ��װ���ñ���̼��������Һ��ȥ������̼�е��Ȼ������壻
(4)���ݻ�ѧ����ʽ������������̼�����Ƶ����������ʵ�����ɵ�̼�����Ƶ�����������ʡ�
(1)Aװ����ָȡ������̼�����װ�ã���̼��ƺ����ᷢ����Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼����Ӧ�����ӷ���ʽΪ��CaCO3+2H+��Ca2++CO2��+H2O��Cװ��ϡ������β������װ�����չ����İ�������ֹ��Ⱦ������ͬʱ�ø���ܿ��Է�������
(2)Bװ���е��Թ��������а����Ȼ��Ƶı�����Һ��ͨ�������̼����ᷢ����Ӧ����̼�����ƺ��Ȼ�泥�����ͼ�������֪�¶�Խ�ͣ�̼�����Ƶ��ܽ��ԽС�������¶�Խ��Խ������̼�����Ƶľ���������
(3)������̼�����к����Ȼ������壬ͨ���Ͱ�����Ӧ��������̼�����ƣ����ԵIJ���̼�����ƾ��壬������Ҫ��һ��ϴ��װ���ñ���̼��������Һ��ȥ������̼�е��Ȼ������壻
(4)����ʳ��ˮ�к�NaCl������Ϊ5.85g�����ݻ�ѧ����ʽ����NH3+CO2+NaCl+H2O�TNH4Cl+NaHCO3(����)�����۵õ�̼����������Ϊ8.4g��ʵ���õ������NaHCO3���������Ϊ5.04g����̼�����ƵIJ��ʣ�![]() ��100%��60%��
��100%��60%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ŵ���ٴ���Ҫ�����������ʪ�Թؽ��ס���ð���յȡ��ϳ�·�����£�
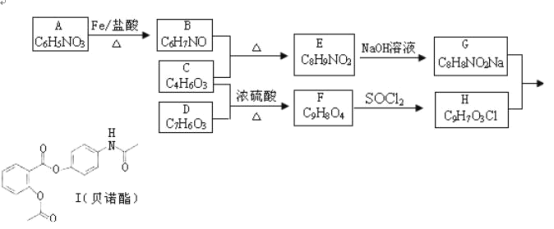
��1����ŵ���ķ���ʽ______��
��2��A��B�ķ�Ӧ������______��G+H��I�ķ�Ӧ������______��
��3��д��������C��G�Ľṹ��ʽ��C______��G______��
��4��д����������������Fͬ���칹��Ľṹ��ʽ����д3�֣�______��
a��������FeCl3��Һ������ɫ��Ӧ��
b���ܷ���������Ӧ��ˮ�ⷴӦ��
c����������Ʒ�Ӧ�ų�H2��
d�������ϵ�һ��ȡ������ֻ�����ֽṹ
��5�����������Ϣ����ƴ�A����������ϳ�![]() �ĺ�����·�������Լ���ѡ��������ͼ��ʾ��д����Ӧ����P��Ҫ��Ӧ������_______________
�ĺ�����·�������Լ���ѡ��������ͼ��ʾ��д����Ӧ����P��Ҫ��Ӧ������_______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ����
A. ��0.1 mol��L��1 CH3COOH��Һ�м�������ˮ����Һ��c(H+)/c(CH3COOH)��С
B. ��CH3COONa��Һ��20 ��������30 �棬��Һ��c(CH3COO-)/c(CH3COOH)c(OH-)����
C. �������м��백ˮ�����ԣ���Һ��![]() >1
>1
D. �����£�pH��2�Ĵ�����Һ��pH��12��NaOH��Һ�������Ϻ���ҺpH��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ��SO2(g)��1/2O2(g)![]() SO3(g)����H����98.32 kJ��mol��1����һ���¶ȵ��ܱ������г���2 mol SO2��1molO2��ַ�Ӧ������һ��ʱ��ų�������Ϊ98.32 kJ���������е�ѹǿ����ʼʱѹǿ�ı�ֵΪ(����)
SO3(g)����H����98.32 kJ��mol��1����һ���¶ȵ��ܱ������г���2 mol SO2��1molO2��ַ�Ӧ������һ��ʱ��ų�������Ϊ98.32 kJ���������е�ѹǿ����ʼʱѹǿ�ı�ֵΪ(����)
A. 3/2B. 2/3C. 6/5D. 5/6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����з���һ����ѧ��Ӧ����Ӧ�����д���H2O��ClO����CN����HCO3����N2��Cl���������ʣ��ڷ�Ӧ�����в��ClO����N2�����ʵ�����ʱ��仯��������ͼ��ʾ�������й��ж�����ȷ���ǣ� ��
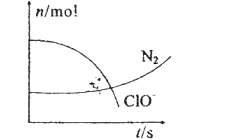
A.��ԭ���Ǻ�CN�������ʣ��������ﲻֻ��N2
B.��������ClO������ԭ������HCO3��
C.��ƽ���������뻹ԭ���Ļ�ѧ������֮��Ϊ5��2
D.������2��24LN2��ת�Ƶ���1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(15 ��)������H �Ǻϳ�ҩ������ɳ����������Ҫ�м��壬��ϳ�·�����£�
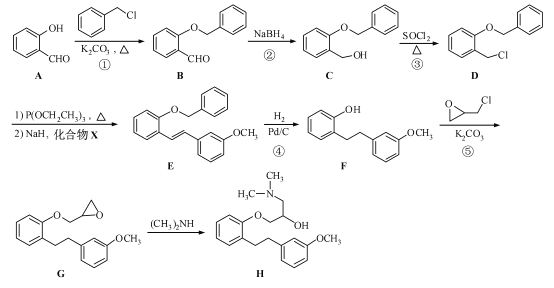
(1)������A �еĺ���������Ϊ �� (�����������)��
(2)��Ӧ�١����У�����ȡ����Ӧ���� (�����)��
(3)д��ͬʱ��������������B ��һ��ͬ���칹��Ľṹ��ʽ�� ��
I. �����к�������������II. ��������7 �ֲ�ͬ��ѧ�������⣻III. ������FeCl3��Һ������ɫ��Ӧ����ˮ�����֮һ�ܷ����˷�Ӧ��
(4)ʵ��D��E ��ת���У�����Ļ�����X �ܷ���������Ӧ��X �Ľṹ��ʽΪ ��
(5)��֪��![]() ��������
�������� �Ǻϳɿ���ҩ���������м��壬��д����
�Ǻϳɿ���ҩ���������м��壬��д����![]() ��
��![]() Ϊԭ���Ʊ��û�����ĺϳ�·������ͼ(���Լ�����)���ϳ�·������ͼʾ�����£�
Ϊԭ���Ʊ��û�����ĺϳ�·������ͼ(���Լ�����)���ϳ�·������ͼʾ�����£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣��ش����⣺
�� | |||||||
�� | |||||||
�� | �� | �� | |||||
�� |
��1���ٺ͢��γɵ��������Ľṹʽ��__________���÷��ӵĿռ乹����________��
��2����Ԫ��λ��Ԫ�����ڱ� ___ ���������ӵ��Ų�ʽ _________ ��ԭ�Ӻ����� _______��������ͬ�ĵ��ӡ�CCl4 ��һ�ֳ������л��ܼ����ж������� _______ ������ԡ������Ǽ��ԡ������ۼ���_________ ���ӣ�����ԡ������Ǽ��ԡ�����
��3��ijԪ��3P�Dz���ֻ��һ�����ӣ��ж���������ڣ������Ӱ뾶��С ______ ���������ű�ʾ����д����Ԫ�ص�����Ԫ�آ�����������Ӧˮ���ﷴӦ�Ļ�ѧ����ʽ��________��
��4�����һ��ʵ�鷽�����ȽϢ�����������Ե�ǿ���������±���
ʵ�鲽�� | ________ |
ʵ������ | ________ |
ʵ��ԭ�� | ________ |
ʵ����� | ________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
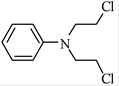
����Ŀ������̪(J)�������ᡢ�жȼ�����ȱѪ��ҩ��ϳ�J��һ��·�����£�

��֪��
��E�ĺ˴Ź�������ֻ��һ��壻
��C�ܷ���������Ӧ��
��J��һ�����������г����������һ����Ԫ����
�ش��������⣺
��1����A����B�Ļ�ѧ����ʽΪ__________���䷴Ӧ����Ϊ__________��
��2��D�Ļ�ѧ������__________����D����E�Ļ�ѧ����ʽΪ__________��
��3��J�Ľṹ��ʽΪ__________��
��4��G��ͬ���칹���к˴Ź���������4���������FeCl3��Һ������ɫ��Ӧ�Ľṹ��ʽ__________(д��һ�ּ���)��
��5���ɼ�ȩ�ͻ�����A�����в���ɵõ�2һ�����Ҵ���
![]()
��Ӧ����1Ϊ__________����Ӧ����2��ѡ����Լ�Ϊ__________��L�Ľṹ��ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���SiO2ϸ�۷�������ˮ�У�������ƽ�⣬����H4SiO4��Һ��SiO2+2H2OH4SiO4�����÷�Ӧƽ�ⳣ��K���¶ȵı仯��ͼʾ������1Сʱ�����H4SiO4����������Ϊ0.01%����Һ�ܶ�Ϊ1.0g/mL�������з�����ȷ���ǣ�������
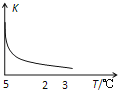
A.�÷�Ӧƽ�ⳣ���ı���ʽΪK=c��H4SiO4��
B.������H4SiO4�ķ�ӦΪ���ȷ�Ӧ
C.��H4SiO4��ʾ�ķ�Ӧ����Ϊ1.04��10��2mol/��Lh��
D.��Kֵ�����ƽ���ƶ�ʱ�淴Ӧ�����ȼ�С������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com