
 Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.分析 (1)写出Ti2+核外电子排布式,判断其最高能层和该能层下的原子轨道数;
(2)a.根据价层电子对互斥理论确定杂化方式;
b.等电子体为原子数相等和价电子数相等的原子团;
c.分子间存在氢键的熔沸点高;
d.提供孤电子对的原子是配原子;
(3)根据价层电子对互斥理论确定其杂化类型;等电子体是具有相同的价电子数和相同原子数的微粒;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)离子晶体的晶格能与离子半径成反比,与离子所带电荷成正比;
(6)根据NaCl晶体结构判断:Na+位于顶点与它次近邻的Cl-位于晶胞的体心位置,据此判断次近邻的Cl-数目和距离;
(7)NaCl晶胞为面心立方密堆积,则晶胞的边长为(2a+2b)pm,计算出Na+和Cl-所占体积和晶胞体积,从而计算出空间利用率.
解答 解:(1)基态Ti2+价电子排布式为:3d2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道,
故答案为:M;9;
(2)a.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对是4,采用sp3杂化,故a错误;
b.等电子体为原子数相等和价电子数相等的原子团,NH+4与PH+4、CH4、BH-4均含有5个原子团,且价电子均为8,为等电子体,而ClO-4价电子数为32,不属于等电子体,故b错误;
c.分子间存在氢键的熔沸点高,相同压强时,氨气中含有氢键,PH3中不含氢键,所以NH3沸点比PH3高,故c正确;
d.提供孤电子对的原子是配原子,[Cu(NH3)4]2+离子中,N原子提供孤对电子,N原子为配原子,故d正确;
故答案为:cd;
(3)ClO2-中心氯原子的价层电子对个数n=$\frac{7+1}{2}$=4,属于sp3杂化;等电子体具有相同的电子数目和原子数目的微粒,所以与ClO2-互为等电子体的分子为Cl2O、OF2等;
故答案为:sp3;Cl2O或OF2;
(4)H5IO6(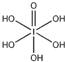 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,
故答案为:<;
(5)离子晶体中离子电荷越多,半径越小离子键越强,离子晶体的晶格能越大,已知已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,所以发生的反应为CsICl2=CsCl+ICl,
故答案为:A;
(6)Na+位于顶点,被8个晶胞共有,即Na+与跟它次近邻的Cl-个数为8;Na+与跟它次近邻的Cl-之间的距离为晶胞体对角线的一半,距离为$\sqrt{3}$r,
故答案为:8;$\sqrt{3}$r;
(7)晶胞中共含有4个Na+和4个Cl-,体积为:$\frac{4}{3}$π(a3+b3)×4,晶胞的边长为a+b,晶胞体积为(2a+2b)3,氯化钠晶体中离子的空间利用率为:$\frac{\frac{4}{3}π({a}^{3}+{b}^{3})×4}{(2a+2b)^{3}}$=$\frac{2π}{3}×\frac{({a}^{3}+{b}^{3})}{(a+b)^{3}}×100%$,
故答案为:$\frac{2π}{3}×\frac{({a}^{3}+{b}^{3})}{(a+b)^{3}}×100%$.
点评 本题考查物质结构和性质,涉及核外电子排布、杂化方式的判断等知识点,题目难度中等.明确常见晶胞结构类型、杂化原理的熟练应用为解答关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素.
已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正化合价与最低负化合价的代数和为6,D是同周期中离子半径最小的元素.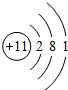 ,用电子式写出C和E形成化合物的过程
,用电子式写出C和E形成化合物的过程 ,用电子式写出A和B形成化合物的过程
,用电子式写出A和B形成化合物的过程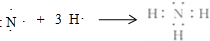 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| n(A)/mol | 0.40 | - | 0.20 | - | - | 0.10 |
| n(B)/mol | 0.00 | 0.24 | - | 0.52 | 0.60 | 0.60 |
| A. | 0~40 s的平均反应速率v(B)=0.01 mol•L-1•s-1 | |
| B. | 80 s时容器中混合气体的密度小于40 s时混合气体的密度 | |
| C. | 其他条件不变,加入合适的催化剂,0~80 s时间段内v(A)>0.001 875 mol•L-1•s-1 | |
| D. | 反应达到最大限度后,增加A的浓度,B的生成速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质钠放入水中:Na+H2O═Na++OH-+H2↑ | |
| B. | 二氧化硅溶于NaOH溶液:SiO2+2OH-═SiO32-+H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g由乙烯与丙烯组成的混合物中含有氢原子的数目为NA | |
| C. | 1mol Al3+含有的核外电子数为3NA | |
| D. | 某密闭容器装有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com