
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g由乙烯与丙烯组成的混合物中含有氢原子的数目为NA | |
| C. | 1mol Al3+含有的核外电子数为3NA | |
| D. | 某密闭容器装有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
分析 A.气体摩尔体积使用对象为气体;
B.乙烯与丙烯的最简式相同为CH2,根据n=$\frac{m}{M}$计算最简式的物质的量,H原子物质的量是最简式的2倍,再根据N=nNA计算;
C.1个铝离子核外有10个电子;
D.氮气与氢气合成氨气为可逆反应,可逆反应不能进行到底;
解答 解:A.标况下,HF为液体,不能使用气体摩尔体积,故A错误;
B.乙烯与丙烯的最简式相同为CH2,最简式的物质的量为$\frac{7g}{14g/mol}$=0.5mol,故H原子物质的量为1mol,含有H原子数目为NA,故B正确;
C.1mol Al3+含有的核外电子数为10NA,故C错误;
D.氮气与氢气合成氨气为可逆反应,可逆反应不能进行到底,所以0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目小于0.6NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件是解题关键,注意可逆反应不能进行到底的特点,题目难度不大.


科目:高中化学 来源: 题型:解答题
 Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Z>Y | |
| B. | X与W能形成共价化合物 | |
| C. | Y与Z组成的化合物溶于水呈酸性 | |
| D. | 元素X、Y、W的最高化合价均与其族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
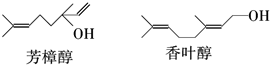
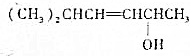 的键线式结构为
的键线式结构为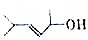 下列说法不正确的是( )
下列说法不正确的是( )| A. | 两种醇都能与溴水反应 | |
| B. | 两种醇互为同分异构体 | |
| C. | 两种醇与氧气在铜催化的条件下,均可被氧化为相应的醛 | |
| D. | 两种醇在浓H2S04存在下加热,均可与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH固体 | B. | 水 | C. | CuSO4固体 | D. | 氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到表面皿上的pH试纸上测pH | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 取金属钠时,要先用镊子夹取,再用小刀切下所需量,剩余钠不能放回原试剂瓶中 | |
| D. | 用NaOH标准溶液滴定盐酸,滴定管尖嘴部分若在滴定前无气泡,滴定终点时出现气泡,测定结果将偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | 420 | 7 | 9 | ||
| Ⅲ | 探究催化剂对该反应速率的影响 | 10 | 7 | 9 | |
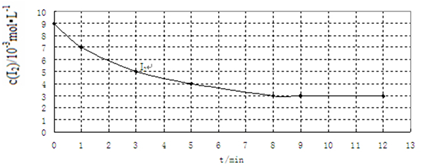
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
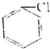 ②
② ③(CH3)3CCH2Cl ④CHCl-CHBr2⑤
③(CH3)3CCH2Cl ④CHCl-CHBr2⑤ ⑥CH3Cl.
⑥CH3Cl.| A. | ②③⑤ | B. | ①③⑥ | C. | 全部 | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑦ | B. | ②③⑤⑧⑨ | C. | ②③⑥⑦⑨ | D. | ①④⑤⑧⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com